1. Thang đo pH
Trước đây các nhà hoá học thường đo tính acid của một dung dịch bằng cách đo nồng độ ion hydrogen của nó. Vào năm 1909, nhà hoá học người Đan Mạch Soren Peter Lauritz Sorensen đề xuất một phương pháp thuận tiện hơn, ông định nghĩa
\({\rm{pH}} = - \log [{{\rm{H}}^ + }]\),
trong đó \([{{\rm{H}}^ + }]\) là nồng độ của các ion hydrogen được đo bằng mol/lít (M). Ông làm điều này để tránh những số rất nhỏ và số mũ âm. Ví dụ, nếu \([{{\rm{H}}^ + }] = {10^{ - 4}}\) M thì \({\rm{pH}} = - \log [{10^{ - 4}}] = 4\).
Dung dịch có độ pH = 7 được xác định là trung tính, dung dịch có độ pH < 7 có tính acid và dung dịch có độ pH > 7 là dung dịch base. Nhận thấy rằng khi pH tăng 1 đơn vị thì \([{{\rm{H}}^ + }]\) giảm đi 10 lần.
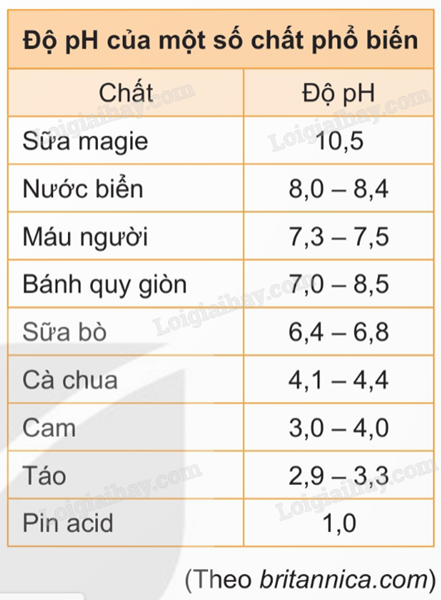
2. Cách tính độ pH ứng dụng logarit
Áp dụng công thức \({\rm{pH}} = - \log [{{\rm{H}}^ + }]\).
Ví dụ minh hoạ:
1) Sử dụng máy tính cầm tay để tính độ pH trong mỗi trường hợp sau (làm tròn kết quả đến hàng phần mười):
a) Bia có \([{H^ + }] = 0,00008\);
b) Rượu có \([{H^ + }] = 0,0004\).
(Nguồn: Giải tích 12 Nâng cao, NXBGD Việt Nam, 2021).
Giải:
a) \(pH = - \log [{H^ + }] = - \log (0,00008) \approx 4,1\).
b) \(pH = - \log [{H^ + }] = - \log (0,0004) \approx 3,4\).
2) Độ pH của một dung dịch hoá học được tính theo công thức \(pH = - \log [{H^ + }]\), trong đó \([{{\rm{H}}^ + }]\) là nồng độ (tính theo mol/lít) của các ion hydrogen. Giá trị pH nằm trong khoảng từ 0 đến 14. Nếu pH < 7 thì dung dịch có tính acid, nếu pH > 7 thì dung dịch có tính base, còn nếu pH = 7 thì dung dịch là trung tính.
a) Tính độ pH của dung dịch có nồng độ ion hydrogen bằng 0,01 mol/lít.
b) Xác định nồng độ ion hydrogen của một dung dịch có độ pH bằng 7,4.
Giải:
a) Khi \([{{\rm{H}}^ + }] = 0,01\), ta có:
\({\rm{pH}} = - \log 0,01 = - \log {10^{ - 2}} = 2.\)
b) Nồng độ ion hydrogen trong dung dịch đó là \([{{\rm{H}}^ + }] = {10^{ - 7,4}}\).
3) Trong hoá học, độ pH của một dung dịch được tính theo công thức \({\rm{pH}} = - \log [{{\rm{H}}^ + }]\), trong đó \([{{\rm{H}}^ + }]\) là nồng độ \({{\rm{H}}^ + }\) (ion hydrogen) tính bằng mol/L. Các dung dịch có pH bé hơn 7 thì có tính acid, có pH lớn hơn 7 thì có tính kiềm, có pH bằng 7 thì trung tính.
a) Tính độ pH của dung dịch có nồng độ \({{\rm{H}}^ + }\) là 0,0001 mol/L. Dung dịch này có tính acid, kiềm hay trung tính?
b) Dung dịch A có nồng độ \({{\rm{H}}^ + }\) gấp đôi nồng độ \({{\rm{H}}^ + }\) của dung dịch B.
Độ pH của dung dịch nào lớn hơn và lớn hơn bao nhiêu? Làm tròn kết quả đến hàng phần nghìn.
Giải:
a) \({\rm{pH}} = - \log 0,0001 = - \log {10^{ - 4}} = 4\log 10 = 4\).
Do \(4 < 7\) nên dung dịch có tính acid.
b) Kí hiệu \({\rm{p}}{{\rm{H}}_A}\), \({\rm{p}}{{\rm{H}}_B}\) lần lượt là độ pH của hai dung dịch A và B; \({[{{\rm{H}}^ + }]_A}\), \({[{{\rm{H}}^ + }]_B}\) lần lượt là nồng độ của hai dung dịch A và B. Ta có:
\({\rm{p}}{{\rm{H}}_A} = - \log {[{{\rm{H}}^ + }]_A} = - \log (2{[{{\rm{H}}^ + }]_B}) = - \log 2 - \log {[{{\rm{H}}^ + }]_B} = - \log 2 + {\rm{p}}{{\rm{H}}_B}\).
Suy ra \({\rm{p}}{{\rm{H}}_B} - {\rm{p}}{{\rm{H}}_A} = \log 2 \approx 0,301\).
Vậy dung dịch B có độ pH lớn hơn và lớn hơn khoảng 0,301.
4) Nồng độ ion hydrogen của nước chanh là \(\left[ {{H^ + }} \right] = 5,{0.10^{ - 3}}M.\) Hãy tính độ pH của nước chanh và cho biết nó có tính acid hay base.
Giải:
Độ pH của nước chanh là:
\(pH = - \log \left( {5,{{0.10}^{ - 3}}} \right) \approx 2,3\).
Mà 2,3 < 7 nên nước chanh có tính acid.

 Một vài mô hình toán học sử dụng hàm số mũ và hàm số lo..
Một vài mô hình toán học sử dụng hàm số mũ và hàm số lo.. 






Danh sách bình luận