Bài 18. Nguyên tố nhóm IIA trang 121, 122, 123 Hóa 12 Cánh diều
Nguyên tố nhóm IIA và một số hợp chất của chúng có nhiều ứng dụng trong thực tiễn
CH tr 121
Trả lời câu hỏi Mở đầu trang 121 SGK Hóa 12 Cánh diều
Nguyên tố nhóm IIA và một số hợp chất của chúng có nhiều ứng dụng trong thực tiễn (Hình 18.1).
a) Nêu một số ứng dụng của đơn chất và hợp chất của nguyên tố nhóm IIA mà em biết.
b) Kim loại nhóm IIA có những tính chất vật lí và tính chất hóa học nào?
Phương pháp giải:
Dựa vào hình 18.1

Lời giải chi tiết:
a) Ứng dụng đơn chất: Mg, Ca là các nguyên tố vi lượng trong cơ thể con người. Ba là chất cản quang trong y tế.
Ứng dụng của hợp chất: CaCO3 dùng để sản xuất xi măng.
b) Kim loại nhóm IIA có tính chất vật lí: khối lượng riêng nhỏ, độ nóng chảy cao hơn nhóm IA. Tính chất hóa học: thể hiện tính khử
CH tr 123 CH1
Trả lời câu hỏi 1 trang 123 SGK Hóa 12 Cánh diều
Trong cùng chu kì, kim loại nhóm IIA có tính khử mạnh hơn hay yếu hơn so với tính khử của kim loại nhóm IA. Giải thích.
Phương pháp giải:
Dựa vào xu hướng biến đổi trong bảng tuần hoàn.
Lời giải chi tiết:
Trong cùng một chu kì, kim loại nhóm IIA có tính khử yếu hơn tính khử của kim loại nhóm IA.
Vì theo chiều tăng dần điện tích hạt nhân, bán kính nguyên tử giảm dần khiến tính khử IA lớn hơn IIA.
CH tr 123 CH2
Trả lời câu hỏi 2 trang 123 SGK Hóa 12 Cánh diều
Dựa vào tính khử của kim loại và độ tan của các hydroxide, dự đoán:
a) Magnesium hay barium phản ứng với oxygen mạnh hơn
b) Calcium hay barium phản ứng với nước mạnh hơn.
Phương pháp giải:
Theo chiều tăng điện tích hạt nhân, bán kính của nguyên tử có xu hướng tăng dần từ Br đến Ba. Nên tính khử tăng dần từ Be đến Ba.
Lời giải chi tiết:
Theo chiều tăng điện tích hạt nhân, bán kính của nguyên tử có xu hướng tăng dần từ Br đến Ba. Nên tính khử tăng dần từ Be đến Ba
a) Mg có tính khử yếu hơn Ba nên Ba phản ứng với oxygen mạnh hơn
b) Ba có tính khử mạnh hơn Ca nên phản ứng với nước mạnh hơn.
CH tr 124 CH
Trả lời câu hỏi trang 124 SGK Hóa 12 Cánh diều
Vì sao magnesium phản ứng rất chậm với nước?
Phương pháp giải:
Dựa vào bảng 18.2.

Lời giải chi tiết:
Vì độ tan của Mg(OH)2 nhỏ hơn phản ứng của Mg và H2O nên Mg phản ứng rất chậm với nước.
CH tr 124 VD
Trả lời câu hỏi Vận dụng trang 124 SGK Hóa 12 Cánh diều
Tìm hiểu và cho biết ngoài tham gia tạo hợp kim, các kim loại nhóm IIA còn có những ứng dụng nào khác.
Phương pháp giải:
Dựa vào ứng dụng của kim loại IIA
Lời giải chi tiết:
Kim loại IIA ngoài tham gia tạo hợp kim, các kim loại IIA còn tham gia vào chế tạo pháo hoa, thuốc bổ sung calcium, chất phản quang trong y học.
CH tr 124 LT
Trả lời câu hỏi Luyện tập trang 124 SGK Hóa 12 Cánh diều
Magnesium là kim loại cơ bản trong hợp kim dùng để chế tạo khung và cánh của các thiết bị bay (Hình 18.3). Theo em, ứng dụng trên dựa vào tính chất vật lí nào của hợp kim magnesium?
Phương pháp giải:
Dựa vào ứng dụng của kim loại IIA
Lời giải chi tiết:
Dựa vào độ bền và nhẹ, khó bị oxy hóa của Mg
CH tr 125 TH
Trả lời câu hỏi Thực hành trang 125 SGK Hóa 12 Cánh diều
So sánh độ tan của muối BaSO4 và CaSO4
Chuẩn bị:
- Hóa chất: Dung dịch BaCl2, CaCl2 cùng nồng độ 0,1M; dung dịch CuSO4 5%.
- Dụng cụ: ống nghiệm, ống hút nhỏ giọt
Tiến hành: Cho 2ml dung dịch BaCl2 vào ống nghiệm (1), 2ml dung dịch CaCl2 vào ống nghiệm (2). Cho từ từ từng giọt dung dịch CuSO4 vào mỗi ống nghiệm và lắc đều cho đến khi có kết tủa trong ống nghiệm thì dừng lại
Yêu cầu: Quan sát hiện tượng, so sánh thời điểm xuất hiện kết tủa trong mỗi ống nghiệm, giải thích.
Phương pháp giải:
Dựa vào độ tan của muối Ca2+ và Ba2+
Lời giải chi tiết:
Hiện tượng: Ống nghiệm (1) xuất hiện kết tủa trắng, ống nghiệm (2) thấy xuất hiện vẩn đục trắng
Thời điểm xuất hiện kết tủa ở ống nghiệm (1): ngay khi cho vào; ống nghiệm (2) một lúc sau.
Giải thích: Vì BaSO4 là chất không tan trong nước, CaSO4 là chất ít tan trong nước.
CH tr 125 CH
Trả lời câu hỏi trang 125 SGK Hóa 12 Cánh diều
Phản ứng giữa các chất nào sau đây tạo ra chất không tan?
a) K2CO3 + Ca(OH)2 \( \to \)?
b) H2SO4 + NaOH \( \to \)?
c) HNO3 + Mg(OH)2 \( \to \)?
d) Na2SO4 + Ba(OH)2 \( \to \)?
Phương pháp giải:
Dựa vào Bảng 18.3
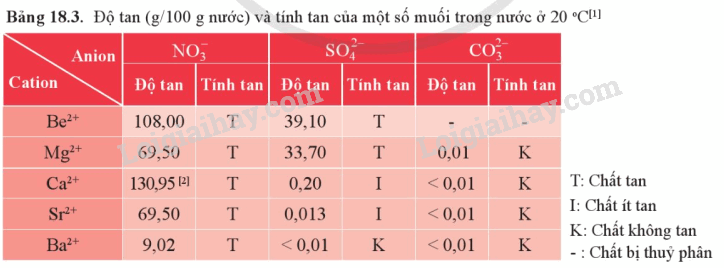
Lời giải chi tiết:
a) K2CO3 + Ca(OH)2 \( \to \) KOH + CaCO3\( \downarrow \)
d) Na2SO4 + Ba(OH)2 \( \to \)NaOH + BaSO4\( \downarrow \)
CH tr 125 LT
Trả lời câu hỏi Luyện tập trang 125 SGK Hóa 12 Cánh diều
Vì sao các khoáng vật calcite, dolomite,… hầu như không tan trong nước?
Phương pháp giải:
Dựa vào bảng 18.3

Lời giải chi tiết:
Các khoáng vật calcite, dolomite là muối của Mg và Ca với CO32-, nên hầu như không tan trong nước.
CH tr 126 CH1
Trả lời câu hỏi 1 trang 126 SGK Hóa 12 Cánh diều
Dùng nước có thể phân biệt MgCO3(s) và Mg(NO3)2(s) được không. Giải thích.
Phương pháp giải:
Dựa vào bảng 18.3

Lời giải chi tiết:
Có thể dùng nước để phân biệt MgCO3 và Mg(NO3)2. Vì MgCO3 không tan trong nước, Mg(NO3)2 tan hoàn toàn trong nước.
CH tr 126 LT1
Trả lời câu hỏi Luyện tập 1 trang 126 SGK Hóa 12 Cánh diều
Một mẫu nước giếng có chứa các ion Ca2+, Na+, Mg2+, Cl- và SO42-. Viết phương trình hóa học của các phản ứng tạo chất không tan khi cho dung dịch soda vào mẫu nước giếng trên.
Phương pháp giải:
Dựa vào bảng 18.3

Lời giải chi tiết:
Dung dịch soda gồm ion: Na+ và CO32-. Khi cho vào mẫu nước giếng chứa các ion Mg2+, Ca2+, Na+, Cl-, SO42- sẽ tạo ra các chất không tan sau:
Ca2+ + CO32- \( \to \)CaCO3\( \downarrow \)
Mg2+ + CO32- \( \to \) MgCO3\( \downarrow \)
CH tr 126 LT2
Trả lời câu hỏi Luyện tập 2 trang 126 SGK Hóa 12 Cánh diều
Vì sao khi có sự gia tăng nồng độ của carbon dioxide trong nước biển thì các rạn san hô và núi đá vôi có thể bị phá hủy xói mòn?
Phương pháp giải:
Các rạn san hô và núi đá vôi có phản ứng với carbon dioxide
Lời giải chi tiết:
Các rạn san hô và núi đá vôi có thể bị phá hủy xói mòn theo phương trình:
CaCO3 + CO2 + H2O \( \to \) Ca(HCO3)2
CH tr 126 CH2
Trả lời câu hỏi 2 trang 126 SGK Hóa 12 Cánh diều
Dựa vào Bảng 18.4, hãy cho biết quá trình phân hủy 1 mol muối carbonate của nguyên tố nhóm IIA nào cần hấp thu nhiều năng lượng hơn.
Phương pháp giải:
Dựa vào bảng 18.4
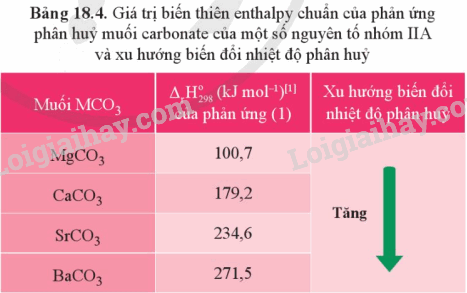
Lời giải chi tiết:
Quá trình phân hủy 1 mol muối carbonate của nguyên tố barium cần nhiều nhiệt nhất: 271,5 kJ
CH tr 127
Trả lời câu hỏi Thực hành trang 127 SGK Hóa 12 Cánh diều
Thí nghiệm kiểm tra sự có mmặt của các ion Ca2+, Ba2+, SO42-, CO32-
Chuẩn bị:
- Hóa chất: Dung dịch CaCl2 0,1M; Na2CO3 0,1M; HCl 1,0M
- Dụng cụ: Ống nghiệm, ống hút nhỏ giọt
Tiến hành: Cho vào ống nghiệm khoảng 2ml dung dịch CaCl2, thêm từ từ cho đến hết khoảng 10 giọt dung dịch Na2CO3. Tiếp tục thêm vào khoảng 10 giọt dung dịch HCl, lắc đều
Yêu cầu: Quan sát, mô tả hiện tượng và viết phương trình hóa học của phản ứng xảy ra.
Phương pháp giải:
Dựa vào tính tan muối ion Ca2+
Lời giải chi tiết:
Hiện tượng: tạo ra kết tủa trắng, sau đó tan dần khi thêm HCl và tạo bọt khí
PTHH: CaCl2 + Na2CO3 \( \to \) CaCO3 + 2NaCl
CaCO3 + 2HCl \( \to \) CaCl2 + CO2 + H2O
CH tr 128 TH1
Trả lời câu hỏi Thực hành 1 trang 128 SGK Hóa 12 Cánh diều
Thí nghiệm kiểm tra sự có mặt của ion Ba2+ trong dung dịch
Chuẩn bị:
- Hóa chất: Dung dịch BaCl2 0,1M; H2SO4 0,1M
- Dụng cụ: Ống nghiệm, ống hút nhỏ giọt
Tiến hành: Cho vào ống nghiệm khoảng 2 ml dung dịch BaCl2, thêm từ từ cho đến hết khoảng 6 – 8 giọt dung dịch H2SO4, lắc đều
Yêu cầu: Quan sát, mô tả hiện tượng và viết phương trình hóa học của phản ứng xảy ra.
Phương pháp giải:
Dựa vào tính tan của muối Ba2+
Lời giải chi tiết:
Hiện tượng: có kết tủa trắng xuất hiện
PTHH: BaCl2 + H2SO4 \( \to \)BaSO4 + 2HCl
CH tr 128 TH2
Trả lời câu hỏi Thực hành 2 trang 128 SGK Hóa 12 Cánh diều
Thí nghiệm kiểm tra sự có mặt của ion SO42- trong dung dịch
Chuẩn bị:
- Hóa chất: Dung dịch ZnSO4 0,1M; BaCl2 0,1M; HCl 1,0M.
- Dụng cụ: ống nghiệm, ống hút nhỏ giọt
Tiến hành: Cho vào ống nghiệm khoảng 2ml dung dịch ZnSO4, thêm từ từ cho đến hết khoảng 10 giọt dung dịch BaCl2, lắc ống nghiệm. Tiếp theo thêm vào khoảng 2 – 3 giọt dung dịch HCl, lắc đều.
Yêu cầu: Quan sát, mô tả hiện tượng và viết phương trình hóa học của phản ứng xảy ra.
Phương pháp giải:
Dựa vào tính tan của muối Ba2+
Lời giải chi tiết:
Hiện tượng: có kết tủa trắng xuất hiện
PTHH: ZnSO4 + BaCl2 \( \to \) BaSO4 + ZnCl2
Khi thêm tiếp dung dịch HCl, không có hiện tượng xảy ra, kết tủa không tan.
CH tr 128 TH3
Trả lời câu hỏi Thực hành 3 trang 128 SGK Hóa 12 Cánh diều
Thí nghiệm kiểm tra sự có mặt của ion CO32- trong dung dịch
Chuẩn bị
- Hóa chất: Dung dịch Na2CO3 1,0M, HCl 1M.
- Dụng cụ: Ống nghiệm, ống hút nhỏ giọt, giất chỉ thị pH
Tiến hành: Cho vào ống nghiệm khoảng 1ml dung dịch Na2CO3. Dùng giấy chỉ thị PH để kiểm tra môi trường dung dịch. Thêm tiếp 2 ml dung dịch HCl vào ống nghiệm, lắc đều, đưa que diêm đang cháy đến miệng ống nghiệm.
Yêu cầu: Quan sát, mô tả hiện tượng và viết phương trình hóa học của phản ứng xảy ra.
Phương pháp giải:
Muối carbonate của ion Na+ có môi trường base.
Lời giải chi tiết:
Hiện tượng: giấy chỉ thị pH khi chưa cho dung dịch HCl sẽ đổi sang màu xanh do Na2CO3 có môi trường base.
Sau khi cho dung dịch HCl vào Na2O3 và đưa que diêm đang cháy đến miệng ống nghiệm, que diêm tắt do khí CO2 không duy trì sự cháy
PTHH: Na2CO3 + 2HCl \( \to \) NaCl + CO2 + H2O
CH tr 129
Trả lời câu hỏi Vận dụng trang 129 SGK Hóa 12 Cánh diều
Tìm hiều các triệu chứng của các bệnh về răng và xương có liên quan đến sự thiếu hụt calcium trong cơ thể. Đề xuất một số biện pháp để phòng tránh, hạn chế một số bệnh trên.
Phương pháp giải:
Dựa vào vai trò của hợp chất calcium trong cơ thể người.
Lời giải chi tiết:
Khi thiếu hụt calcium trong cơ thể có thể mắc một số triệu chứng: lung lay răng, xương dễ gãy, loãng xương,….
Bổ sung thêm calcium để giảm triệu chứng.
CH tr 130 BT1
Trả lời câu hỏi Bài tập 1 trang 130 SGK Hóa 12 Cánh diều
Nêu các đặc điểm giống nhau và khác nhau về cấu tạo nguyên tử và tính chất giữa kim loại nhóm IIA với kim loại kiềm.
Phương pháp giải:
Dựa vào tính chất của kim loại IA và kim loại IIA.
Lời giải chi tiết:
Tất cả kim loại kiềm đều có cùng kiểu mạng tinh thể lập phương tâm khối và có 1 electron hóa trị lớp ngoài cùng: ns1
Kim loại IIA có 3 kiểu mạng tinh thể: lập phương tâm khối, lập phương tâm diện và lục phương và có 2 electron hóa trị lớp ngoài cùng: ns2
Tính chất hóa học của kim loại IA (Li, Na, K): tan trong nước tạo dung dịch base, tác dụng với phi kim, dung dịch acid.
Tính chất hóa học của kim loại IIA (Be, Mg, Ca, Ba): chỉ có Ca và Ba tan trong nước tạo dung dịch base, Mg và Be không tan trong nước, tác dụng với phi kim, dung dịch acid.
CH tr 130 BT2
Trả lời câu hỏi Bài tập 2 trang 130 SGK Hóa 12 Cánh diều
Dựa vào giá trị thế điện cực chuẩn của kim loại (Bảng 10.1) và giá trị thế điện cực chuẩn của quá trình \(2{H_2}{\rm{O}} + 2e \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {H_2} + 2{\rm{O}}{H^ - }\)là \({E_{2{H_2}{\rm{O}}/2{\rm{O}}{H^ - } + {H_2}}}\)= -0,413 V ở pH = 7, hãy:
a) Sắp xếp Na, Mg, Cu theo dãy tăng dần tính khử của kim loại
b) Giải thích vì sao Na và Mg tác dụng được với nước.
Phương pháp giải:
Dựa vào thế điện cực chuẩn của kim loại.

Lời giải chi tiết:
a) Dãy tăng dần tính khử của kim loại: Cu, Mg, Na
b) Do \(E_{N{a^ + }/Na}^o = - 2,713V\)< \({E_{2{H_2}{\rm{O}}/2{\rm{O}}{H^ - } + {H_2}}}\)=> Phản ứng mạnh với H2O ở nhiệt độ thường
\(E_{M{g^{2 + }}/Na}^o = - 2,356V\)< \({E_{2{H_2}{\rm{O}}/2{\rm{O}}{H^ - } + {H_2}}}\)=> có phản ứng với H2O nhưng chậm.
CH tr 130 BT3
Trả lời câu hỏi Bài tập 3 trang 130 SGK Hóa 12 Cánh diều
Khi cho lượng soda phù hợp vào dung dịch có chứa cation Ca2+ và Mg2+ thì hai cation này sẽ bị tách ra khỏi dung dịch. Viết phương trình hóa học minh họa.
Phương pháp giải:
Dung dịch soda gồm ion Na+ và CO32-.
Lời giải chi tiết:
PTHH: Ca2+ + CO32- \( \to \)CaCO3\( \downarrow \)
Mg2+ + CO32- \( \to \) MgCO3\( \downarrow \)
CH tr 130 BT4
Trả lời câu hỏi Bài tập 4 trang 130 SGK Hóa 12 Cánh diều
Đề xuất phương án phân biệt các dung dịch không màu CaCl2, BaCl2, KCl, NaCl và Na2CO3
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại IA, IIA.
Lời giải chi tiết:
- Lấy một ít các dung dịch cho vào từng ống nghiệm
- Dùng mẩu quỳ tím cho vào từng ống nghiệm
Nếu ống nghiệm nào đổi sang màu xanh thì ống nghiệm chứa Na2CO3
- Dùng dung dịch H2SO4 vào từng ống nghiệm
+ Nếu ống nghiệm nào xuất hiện kết tủa ngay lập tức thì ống nghiệm chứa BaCl2
+ Nếu ống nghiệm nào sau một thời gian có xuất hiện vẩn đục trắng thì ống nghiệm chứa CaCl2
+ Ống nghiệm không có hiện tượng: KCl và NaCl
- Dùng ngọn lửa để phân biệt KC và NaCl
+ KCl cháy cho ngọn lửa màu tím và NaCl cháy cho ngọn lửa màu vàng.
Các bài khác cùng chuyên mục
- Lý thuyết Sơ lược về sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch - Hóa 12 Cánh diều
- Lý thuyết Sơ lược về phức chất - Hóa 12 Cánh diều
- Lý thuyết Sơ lược về kim loại chuyển tiếp dãy thứ nhất - Hóa 12 Cánh diều
- Lý thuyết Nước cứng và làm mềm nước cứng - Hóa 12 Cánh diều
- Lý thuyết Nguyên tố nhóm IIA - Hóa 12 Cánh diều
- Lý thuyết Sơ lược về sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch - Hóa 12 Cánh diều
- Lý thuyết Sơ lược về phức chất - Hóa 12 Cánh diều
- Lý thuyết Sơ lược về kim loại chuyển tiếp dãy thứ nhất - Hóa 12 Cánh diều
- Lý thuyết Nước cứng và làm mềm nước cứng - Hóa 12 Cánh diều
- Lý thuyết Nguyên tố nhóm IIA - Hóa 12 Cánh diều













Danh sách bình luận