1. Tính chất vật lí
- Ở điều kiện thường, sulfur là chất rắn, màu vàng, có 2 dạng thù hình: Sđơn tà và Stà phương.
- Sulfur không tan trong nước, tan ít trong alcohol, tan nhiều trong CS2, benzene, …
2. Tính oxi hoá
Nguyên tắc thể hiện tính oxi hoá: S0 → S-2
- Tác dụng với H2 → H2S (hydrogen sulfide): 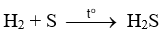
- Tác dụng với kim loại → muối sulfide (S2-)

Hg + S → HgS (PƯ xảy ra ngay điều kiện thường S dùng để xử lí thuỷ ngân rơi vãi)
3. Tính khử
Nguyên tắc: S0 → S+4, S+6
- Tác dụng với phi kim: 
4. Ứng dụng
Khoảng 90% sulfur sản xuất dùng sản xuất H2SO4, 10% phần còn lại: Lưu hoá cao su, sản xuất diêm, thuốc nổ, sản xuất thuốc trừ sâu, thuốc diệt nấm, phẩm nhuộm...

 Nitrogen - Sulfur - Từ điển Hoá 11
Nitrogen - Sulfur - Từ điển Hoá 11 






Danh sách bình luận