1. Nguyên tắc cân bằng theo phương pháp thăng bằng electron
Phương pháp này dựa vào sự bảo toàn e : ∑e nhường = ∑e nhận.
Các bước thực hiện:
Bước 1: Xác định số oxi hoá các nguyên tố có số oxi hoá thay đổi.
Bước 2: Viết các quá trình oxi hoá, quá trình khử (cân bằng mỗi quá trình)\( \to \) tìm hệ số cho mỗi quá trình sao cho ∑e nhường = ∑e nhận.
Bước 3: Xác định hệ số các chất có chứa số oxi hoá thay đổi\( \to \)hoàn chỉnh các hệ số các nguyên tố còn lại dựa trên các định luật bảo toàn (bảo toàn nguyên tố) và theo trình tự sau: Kim loại (ion dương) \( \to \)gốc acid (ion âm) \( \to \) môi trường (acid, base) \( \to \)nước (cân bằng hydrogen).
2. Một số ví dụ về cân bằng theo phương pháp thăng bằng electron
Thí dụ 1: \(\mathop {\rm{C}}\limits^{\rm{0}} {\rm{u}}\,\,{\rm{ + }}\,\,{\rm{H}}\mathop {\rm{N}}\limits^{{\rm{ + 5}}} {{\rm{O}}_{\rm{3}}} \to \mathop {\rm{C}}\limits^{{\rm{ + 2}}} {\rm{u(}}\mathop {\rm{N}}\limits^{{\rm{ + 5}}} \,{{\rm{O}}_{\rm{3}}}{{\rm{)}}_{\rm{2}}}{\rm{ + }}\mathop {\rm{N}}\limits^{{\rm{ + 2}}} {\rm{O + }}{{\rm{H}}_{\rm{2}}}{\rm{O}}\)
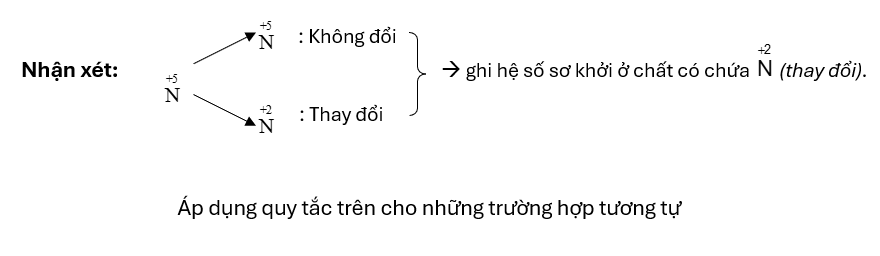
\(\left. {\begin{array}{*{20}{c}}{\mathop {{\rm{3x}}}\limits^{} }\\{\mathop {{\rm{2x}}}\limits^{} }\end{array}} \right|\begin{array}{*{20}{c}}{\mathop {{\rm{Cu}}}\limits^{\rm{0}} \, \to \,\mathop {{\rm{Cu}}}\limits^{{\rm{ + 2}}} \,\,{\rm{ + }}\,\,\,{\rm{2e}}}\\{\mathop {\rm{N}}\limits^{{\rm{ + 5}}} \,\,\,{\rm{ + }}\,\,{\rm{3e}}\,\, \to \,\,\mathop {\rm{N}}\limits^{{\rm{ + 2}}} }\end{array}\)
\(\mathop {{\rm{3C}}}\limits^{\rm{0}} {\rm{u}}\,\,{\rm{ + }}\,\,8{\rm{H}}\mathop {\rm{N}}\limits^{{\rm{ + 5}}} {{\rm{O}}_{\rm{3}}} \to 3\mathop {\rm{C}}\limits^{{\rm{ + 2}}} {\rm{u(}}\mathop {\rm{N}}\limits^{{\rm{ + 5}}} \,{{\rm{O}}_{\rm{3}}}{{\rm{)}}_{\rm{2}}}{\rm{ + }}\mathop {{\rm{2N}}}\limits^{{\rm{ + 2}}} {\rm{O + 4}}{{\rm{H}}_{\rm{2}}}{\rm{O}}\)
Thí dụ 2: 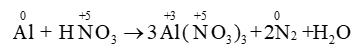
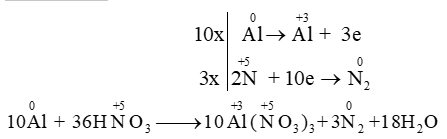
Thí dụ 3: \(\mathop {\rm{S}}\limits^{{\rm{ + 4}}} \,{{\rm{O}}_{\rm{2}}}\,{\rm{ + }}\,\,{\rm{K}}\mathop {{\rm{Mn}}}\limits^{{\rm{ + 7}}} {{\rm{O}}_{\rm{4}}}\,\,{\rm{ + }}\,\,{{\rm{H}}_{\rm{2}}}{\rm{O}} \to {{\rm{H}}_{\rm{2}}}\mathop {\rm{S}}\limits^{{\rm{ + 6}}} {{\rm{O}}_{\rm{4}}}{\rm{ + }}\mathop {{\rm{Mn}}}\limits^{{\rm{ + 2}}} \mathop {\rm{S}}\limits^{{\rm{ + 6}}} {{\rm{O}}_{\rm{4}}}{\rm{ + }}{{\rm{K}}_{\rm{2}}}\mathop {\rm{S}}\limits^{{\rm{ + 6}}} {{\rm{O}}_{\rm{4}}}\)
Nhận xét:
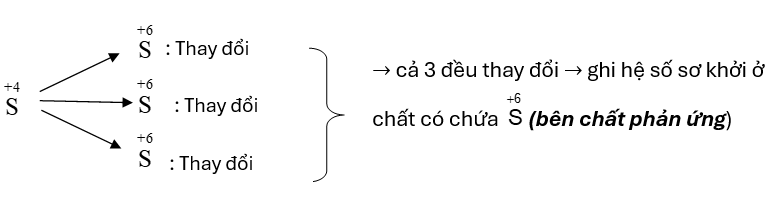
Áp dụng quy tắc trên cho những trường hợp tương tự
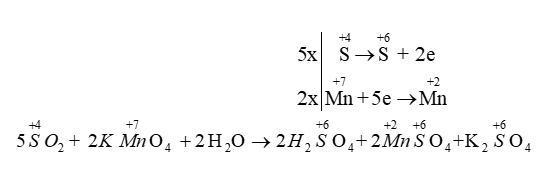
Thí dụ 4: Phản ứng có từ 3 trường hợp thay đổi số oxi hoá trở lên
Cách giải quyết:
- Cách 1: Viết mọi phương trình biểu diễn sự thay đổi số oxi hoá, chú ý sự ràng buộc hệ số ở 2 vế của phản ứng và hệ số trong cùng phân tử.
- Cách 2: Nếu một phân tử có nhiều nguyên tố thay đổi số oxi hoá, có thể xét chung cả nhóm hoặc toàn bộ phân tử, đồng thời chú ý sự ràng buộc hệ số ở phía sau.
\(\mathop {{\rm{Fe}}}\limits^{{\rm{ + 2 }}} \mathop {{{\rm{S}}_{\rm{2}}}}\limits^{ - 1\,\,\,} \,\,{\rm{ + }}\,\,\mathop {{{\rm{O}}_{\rm{2}}}}\limits^{{\rm{0}}\,\,\,{\rm{ }}} \to \mathop {{\rm{F}}{{\rm{e}}_{\rm{2}}}}\limits^{{\rm{ + 3}}} \mathop {{{\rm{O}}_3}}\limits^{ - 2\,\,\,} {\rm{ + }}\mathop {\rm{S}}\limits^{{\rm{ + 4}}} {{\rm{O}}_{\rm{2}}}\)
Áp dụng:
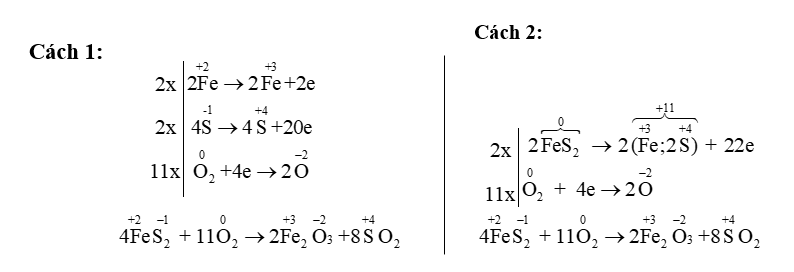
Thí dụ 5: Phản ứng không xác định rõ môi trường
- Cách giải quyết: Có thể cân bằng nguyên tố bằng phương pháp đại số khi đã xác định hệ số của các chất thay đổi số oxi hoá hoặc qua trung gian phương trình ion thu gọn.
- Áp dụng: \({{\rm{K}}_{\rm{2}}}\mathop {\rm{S}}\limits^{{\rm{ + 4}}} \,{{\rm{O}}_{\rm{3}}}\,{\rm{ + }}\,\,{\rm{K}}\mathop {{\rm{Mn}}}\limits^{{\rm{ + 7}}} {{\rm{O}}_{\rm{4}}}\,\,{\rm{ + }}\,\,{\rm{KHS}}{{\rm{O}}_{\rm{4}}} \to {{\rm{K}}_{\rm{2}}}\mathop {\rm{S}}\limits^{{\rm{ + 6}}} {{\rm{O}}_{\rm{4}}}{\rm{ + }}\mathop {{\rm{Mn}}}\limits^{{\rm{ + 2 }}} \mathop {\rm{S}}\limits^{} {{\rm{O}}_{\rm{4}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O}}\)
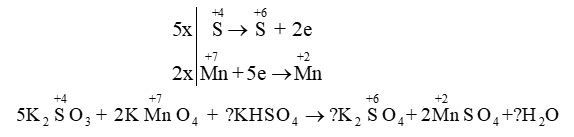
Đặt các hệ số hợp thức của KHSO4 , K2SO4 và H2O là a, b, c.
Bảo toàn nguyên tố K: 12+a =2b ; Bảo toàn nguyên tố H: a=2c ;
Bảo toàn nguyên tố S: 5+a = b+2 => Giải hệ : a=6; b=9; c=3
Vậy: \({\rm{5}}{{\rm{K}}_{\rm{2}}}\mathop {\rm{S}}\limits^{{\rm{ + 4}}} \,{{\rm{O}}_{\rm{3}}}\,{\rm{ + }}\,\,{\rm{2K}}\mathop {{\rm{Mn}}}\limits^{{\rm{ + 7}}} {{\rm{O}}_{\rm{4}}}\,\,{\rm{ + }}\,\,{\rm{6KHS}}{{\rm{O}}_{\rm{4}}} \to {\rm{9}}{{\rm{K}}_{\rm{2}}}\mathop {\rm{S}}\limits^{{\rm{ + 6}}} {{\rm{O}}_{\rm{4}}}{\rm{ + }}\mathop {{\rm{2Mn}}}\limits^{{\rm{ + 2}}} \mathop {\rm{S}}\limits^{} {{\rm{O}}_{\rm{4}}}{\rm{ + 3}}{{\rm{H}}_{\rm{2}}}{\rm{O}}\)
- Cách giải quyết:
- Cách 1: Viết mọi phương trình thay đổi số oxi hoá, đặt ẩn số cho từng nấc tăng, giảm số oxi hoá
( rất dễ nhầm!cẩn thận)
- Cách 2: Tách ra thành hai hay nhiều phản ứng với từng nấc số oxi hoá tăng, hay giảm (có lợi trong việc giải toán). Nhân hệ số trước khi gom các phản ứng lại.
Áp dụng: \(\mathop {{\rm{Al}}}\limits^{\rm{0}} \,\,{\rm{ + }}\,\,{\rm{H}}\mathop {\rm{N}}\limits^{{\rm{ + 5}}} {{\rm{O}}_{\rm{3}}} \to \mathop {{\rm{Al}}}\limits^{{\rm{ + 3}}} {{\rm{(}}\mathop {\rm{N}}\limits^{{\rm{ + 5}}} \,{{\rm{O}}_{\rm{3}}}{\rm{)}}_{\rm{3}}}{\rm{ + }}\mathop {\rm{N}}\limits^{{\rm{ + 2}}} {\rm{O + }}\mathop {{{\rm{N}}_{\rm{2}}}}\limits^{{\rm{ + 1 }}} {\rm{O + }}{{\rm{H}}_{\rm{2}}}{\rm{O}}\)
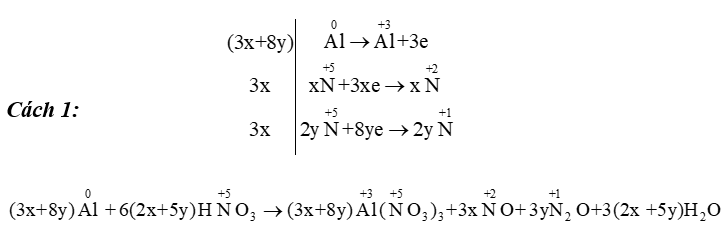
Cách 2: Tách thành 2 phương trình:
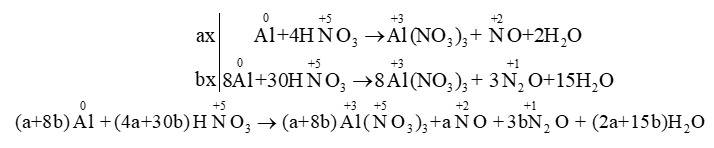
Nhận xét: - Nếu là giải toán, cứ để nguyên các phương trình để tính toán, không cần gom lại.
- Với 2 phương trình trên ta có liên hệ: a=3x; b=y.
- Tuỳ theo đề bài cho tỉ lệ số mol của NO và N2O thì ta mới xác định được hệ số của NO và N2O.
Thí dụ 7: Phản ứng tự oxi hoá – tự khử: Trong đó 1 chất vừa là chất oxi hoá vừa là chất khử ghi hệ số sơ khởi bên chất tạo thành.
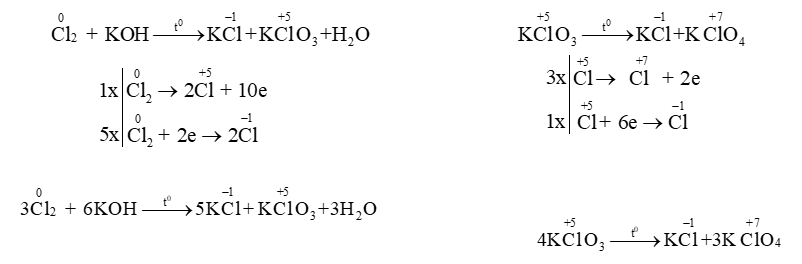
Thí dụ 8: Phản ứng nội oxi hoá - khử: Trong cùng 1 chất mà nguyên tố này đóng vai trò là oxi hoá, nguyên tố kia đóng vai trò là chất khử ghi hệ số sơ khởi bên chất tạo thành.
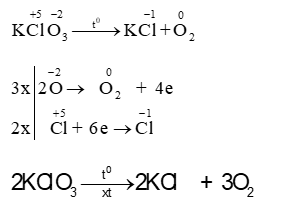
3. Một số chất là chất khử hay chất oxi hoá còn phụ thuộc vào môi trường tiến hành phản ứng
|
Chất |
Môi trường tiến hành phản ứng |
Sản phẩm sau phản ứng |
|
\({\rm{K}}\mathop {{\rm{Mn}}}\limits^{{\rm{ + 7}}\,\,\,\,} {{\rm{O}}_{\rm{4}}}\) |
Môi trường acid (H2SO4) |
\(\mathop {\rm{M}}\limits^{{\rm{ + 2}}} {\rm{n}}\)(MnCl2, MnSO4) |
|
Môi trường trung tính (H2O) |
\(\mathop {\rm{M}}\limits^{{\rm{ + 4}}} {\rm{n}}\) (MnO2, KOH ) |
|
|
Môi trường base |
\(\mathop {\rm{M}}\limits^{{\rm{ + 6}}} {\rm{n}}\) (K2MnO4 ) |
|
|
\({{\rm{K}}_{\rm{2}}}\mathop {{\rm{C}}{{\rm{r}}_{\rm{2}}}}\limits^{{\rm{ + 7 }}} {{\rm{O}}_{\rm{7}}}\) |
Môi trường acid (H2SO4) |
\(\mathop {\rm{C}}\limits^{{\rm{ + 3}}} {\rm{r}}\) Cr2(SO4)3 |
Ví dụ
- Môi trường acid:
10FeSO4 + 2KMnO4 +8H2SO4 → 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
K2Cr2O7 + 6FeSO4 + 7H2SO4 → Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O
- Môi trường trung tính: 3C2H4 + 2KMnO4 + 4H2O → 3 CH2(OH) – CH2OH +2MnO2 + 2KOH
- Môi trường base: Na2SO3 + 2KMnO4 + 2KOHđặc→ Na2SO4 + 2K2MnO4 + H2O

 Phản ứng oxi hoá - khử - Từ điển Hoá 10
Phản ứng oxi hoá - khử - Từ điển Hoá 10 






Danh sách bình luận