1. Phản ứng oxi hoá - khử là gì?
2. Sự cháy
Phản ứng cháy là phản ứng oxi hoá - khử xảy ra ở nhiệt độ cao giữa chất cháy và chất oxi hoá. Trong phản ứng cháy, chất cháy thường là nhiên liệu (than đá, khí thiên nhiên, xăng, dầu,...), còn chất oxi hoá thường là oxygen. Sự cháy kèm theo sự toả nhiệt và phát sáng, tạo ra nhiệt lượng đủ để duy trì sự cháy.
Ví dụ: Phản ứng oxi hoá - khử xảy ra khi đốt cháy carbon trong than đá và butane trong khí gas:
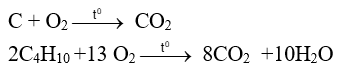
3. Sự han gỉ kim loại
Sau một thời gian sử dụng, nhiều thiết bị, máy móc, vật dụng bằng kim loại thường bị han gỉ do sự oxi hoá của oxygen trong không khí. Đặc biệt, nước ta có khí hậu nhiệt đới, độ ẩm cao nên sự han gỉ kim loại xảy ra rất phổ biến.
Ví dụ: Trong không khí ẩm, các vật dụng bằng thép bị oxi hoá tạo gỉ sắt.
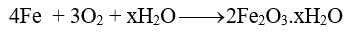
4. Sản xuất hoá chất
5. Chuyển hoá các chất trong tự nhiên
Trong tự nhiên cũng xảy ra rất nhiều quá trình kèm theo phản ứng oxi hoá - khử.
Ví dụ:
Đây là hiện tượng cây lúa phát triển nhanh khi có những cơn mưa rào đầu tiên kèm theo sấm sét vào khoảng cuối mùa xuân.
Tia sét tạo ra tia lửa điện, là điều kiện cho nitrogen phản ứng với oxygen:

Khí NO sinh ra nhanh chóng chuyển hoá thành NO2, sau đó tiếp tục bị oxi hoá thành HNO3:
2NO + O2 → 2NO2
4NO2 +O2 +2H2O → 4HNO3
Nitric acid tan vào nước mưa và chuyển hoá thành gốc nitrate (\(NO_3^ - \)), cung cấp chất đạm cho cây lúa. Nhờ quá trình trên, hằng năm một lượng lớn phân đạm tự nhiên được bổ sung cho đất.
6. Xác định nồng độ một chất bằng phản ứng oxi hoá - khử
Trong thực tế, dung dịch thuốc tím (KMnO4) được sử dụng phổ biến như một tác nhân oxi hoá mạnh để xác định hàm lượng các chất khử như iron (II), hydrogen peroxide, oxalic acid,...
Ví dụ: Trong quá trình bảo quản, một mẫu iron (II) sulfate bị oxi hoá một phần thành hợp chất iron (III). Hàm lượng iron (II) sulfate còn lại trong mẫu được xác định thông qua phản ứng với dung dịch thuốc tím có nồng độ đã biết:
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O

 Phản ứng oxi hoá - khử - Từ điển Hoá 10
Phản ứng oxi hoá - khử - Từ điển Hoá 10 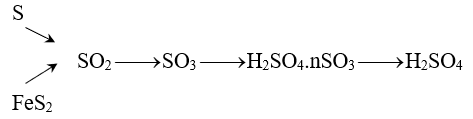







Danh sách bình luận