Bài 3. Ôn tập chương 1 trang 27, 28 Hóa học 11 Kết nối tri thức
Hằng số KC của một phản ứng phụ thuộc vào yếu tố nào sau đây? A. Nồng độ. B. Nhiệt độ. C. Áp suất. D. Chất xúc tác.
CH tr 28
Video hướng dẫn giải
| Câu hỏi:
Câu 1. Hằng số K C của một phản ứng phụ thuộc vào yếu tố nào sau đây? A. Nồng độ. B. Nhiệt độ. C. Áp dụng. D. Căng thẳng. Câu 2. Thêm nước vào 10 mL dung dịch HCI 1,0 mol/l đề được 1 000 mL dung dịch A. Dung dịch mới thu được có pH thay đổi như thế nào so với dung dịch ban đầu? A. pH giảm đi 2 đơn vị. B. Độ pH giảm đi 0,5 đơn vị. C. pH tăng gấp đôi. D. pH tăng 2 đơn vị. Câu 3. Tính pH của các dịch sau: a) Dung dịch NaOH 0,1 M; b) Dung dịch HCI 0,1 M; c) Dung dịch Ca(OH)2 0,01 M. Câu 4. Viết biểu thức cân bằng hằng số K C cho các phản ứng sau: a) 2SO 2 ( g ) + O 2 ( g ) ⇌ 2SO 3 ( g ) b) 2C( s ) + O 2 ( g ) ⇌ 2CO( g ) c) AgCl( s ) ⇌ Ag + (aq) + Cl-(aq) Câu 5. Cho cân bằng hóa học sau: H 2 (g) + I 2 (g) ⇌ 2HI(g) ΔrH 298 o = - 9,6 kJ Nhận xét nào sau đây sai? A. Khi tăng nhiệt độ, cần sử dụng chuyển dịch theo chiều nghịch. B. Ở nhiệt độ không thay đổi, khi tăng áp suất thì cân bằng không bị chuyển dịch. C. Ở nhiệt độ không đổi, khi tăng nhiệt độ H 2 hoặc I 2 , thì giá trị hằng số cân bằng tăng. D. Ở trạng thái cân bằng, tốc độ phản ứng thuận lợi bằng tốc độ phản ứng nghịch. Câu 6. Xét phản ứng xảy ra trong lò luyện gang: Fe 2 O 3 ( s ) + 3CO( g ) ⇌ 2Fe(s) + 3CO 2 ( g ) ∆ r H o < 0 Nêu các yếu tố (nồng độ, nhiệt độ, áp suất) cần tác động vào cân bằng để cân bằng chuyển dịch về bên phải (làm tăng hiệu suất của phản ứng) Câu 7. Cho cân bằng hóa học sau: CO( g ) + H 2 O( g ) ⇌ CO 2 ( g ) + H 2 ( g ) Ở 427 o C, cân bằng hằng số K C = 8,3. Cho 1 mol khí CO và 1 mol hơi nước vào bình kín, dung tích 10 lít và giữ ở 427 o C. Tính nồng độ các chất ở trạng thái cân bằng. |
Phương pháp:
Câu 1. Hằng số K C của một phản ứng phụ thuộc duy nhất vào bản chất của phản ứng và nhiệt độ.
Câu 2. Pha loãng dung dịch 100 lần thì nồng độ giảm 100 lần ⇒ pH tăng 2 đơn vị.
Câu 3.
a) NaOH → Na + +
b) HCl → H + +
c) Ca(OH) 2 → Ca 2+ + 2
Áp dụng công thức: (H + ).()=
pH = -log(H + )
Câu 4. Áp dụng công thức: \({{\rm{K}__{\rm{C}}} = \frac{{{\left( {\rm{C}} \right)}^{ \rm{c}}}{{\left( {\rm{D}} \right)}^{\rm{d}}}}}{{{\left( {\rm{A}} \right )}^{\rm{a}}}{{\left( {\rm{B}} \right)}^{\rm{b}}}}}\)
Câu 5. Hằng số cân bằng chỉ phụ thuộc vào nhiệt độ và chất phản ứng.
Câu 6. Để cân bằng chuyển dịch theo chiều cần thiết:
- Tăng nồng độ CO.
- Giảm nhiệt độ.
- Áp dụng không gây ảnh hưởng đến cân bằng.
Câu 7.
\(\left( {{\rm{CO}}} \right) = \frac{1}{{10}} = 0,{\rm{1 M}}\); \(\left( {{{\rm{H}___2}{\rm{O}}} \right) = \frac{1}{{10}} = 0,{\rm{1 M}}\ )
CO( g ) + H 2 O( g ) ⇌ CO 2 ( g ) + H 2 ( g )
Ban đầu: 0,1 0,1 0 0 M
Phản ứng: x x x x M
Cân bằng: (0,1 – x) (0,1 – x) x x M
Thay đổi công thức số:
\({{\rm{K}__{\rm{C}}} = \frac{{\left( {{\rm{C}}{{\rm{O}__{\rm{2} }}} \right)\left( {{{\rm{H}__{\rm{2}}}} \right)}}{{\left( {{\rm{CO}}} \right) \left( {{{\rm{H}__{\rm{2}}}{\rm{O}}} \right)}}\)
Lời giải chi tiết:
Câu 1. Câu trả lời đúng: B.
Hằng số K C của một phản ứng phụ thuộc duy nhất vào bản chất của phản ứng và nhiệt độ.
Câu 2. Câu trả lời đúng: D.
Pha dịch dịch 100 lần thì nồng độ giảm 100 lần ⇒ pH tăng 2 đơn vị.
Câu 3.
a) NaOH → Na + +
0,1M → 0,1M
Ta có: (H + ).()=
\( \Leftrightarrow \left( {{{\rm{H}}^{\rm{ + }}}} \right) = \frac{{{{10}^{ - 14}}}}{{\left ( {{\rm{O}}{{\rm{H}}^ - }} \right)}} = \frac{{{{10}^{ - 14}}}}{{0,1}} = {10^{ - 13}}\)M
→ pH = -log(H + ) = 13.
b) HCl → H + +
0,1M→ 0,1M
Ta có: pH = -log(H + ) = 1 M.
c) Ca(OH) 2 → Ca 2+ + 2
0,01 → 0,02 M
Ta có: (H + ).(OH) - = 10 -14
\( \Leftrightarrow \left( {{{\rm{H}}^{\rm{ + }}}} \right) = \frac{{{{10}^{ - 14}}}}{{\left ( {{\rm{O}}{{\rm{H}}^ - }} \right)}} = \frac{{{{10}^{ - 14}}}}{{0,02}} = 5 \times {10^{ - 13}}{\rm{M}}\)
→ pH = -log(H + ) = 12,3
Câu 4.
a) 2SO 2 ( g ) + O 2 ( g ) ⇌ 2SO 3 ( g )
\({K_C} = \frac{{{{{\rm{[}}S{O_3}]}^2}}}{{{{{\rm{[}}S{O_2}]}^2}{\rm{[}}{O_2}]}}\)
b) 2C( s ) + O 2 ( g ) ⇌ 2CO( g )
\({{\rm{K}__{\rm{C}}} = \frac{{{{\left( {{\rm{CO}}} \right)}^2}}}{{\ trái( {{{\rm{O}__{\rm{2}}}} \right)}}\)
c) AgCl( s ) ⇌ Ag + (aq) + (aq)
K C = (Ag + ).(Cl - )
Câu 5. Câu trả lời đúng là: C
Hằng số cân bằng chỉ phụ thuộc vào nhiệt độ và chất phản ứng, không phụ thuộc vào nồng độ.
Câu 6. Để cân bằng chuyển dịch theo chiều cần thiết:
- Tăng nồng độ CO, cân bằng sẽ chuyển dịch theo chiều làm giảm nồng độ CO, tức chiều thuận lợi, chiều tăng hiệu suất phản ứng.
- ∆ r H o < 0 ⇒ Chiều thuận lợi cho nhiệt độ ⇒ Giảm nhiệt độ, cân bằng sẽ chuyển dịch theo chiều làm tăng nhiệt độ chiều thuận lợi, chiều tăng hiệu suất phản ứng.
- Phản đối thuận lợi về tổng số lượng các chất khí ở hai vế bằng nhau, việc thay đổi hiệu suất không gây ảnh hưởng đến cân bằng.
Câu 7.
Ta có: [CO] =\(\frac{1}{{10}} = 0,1M\); [H2O] = \(\frac{1}{{10}} = 0,1M\)
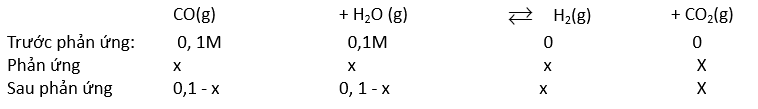
\(\begin{array}{l}{K_C} = \frac{{{\rm{[}}{H_2}]{\rm{[}}C{O_2}]}}{{{\rm{[}}CO]{\rm{[}}{H_2}O]}} = \frac{{x.x}}{{(0,1 - x).(0,1 - x)}} = 8,3\\x = 0,074M\\{\rm{[}}CO] = {\rm{[}}{H_2}O] = 0,1 - 0,074 = 0,026M\\{\rm{[}}{H_2}] = {\rm{[}}C{O_2}] = 0,074M\end{array}\)
Luyện Bài Tập Trắc nghiệm Hóa lớp 11 - Kết nối tri thức - Xem ngay
Các bài khác cùng chuyên mục
- Lý thuyết Hợp chất hữu cơ và hóa học hữu cơ - Hóa học 11 Kết nối tri thức
- Bài 25. Ôn tập chương 6 trang 153, 154 Hóa học 11 Kết nối tri thức
- Bài 24. Carboxylic acid trang 145, 146, 147, 148, 149, 150, 151, 152 Hóa học 11 Kết nối tri thức
- Bài 23. Hợp chất carbonyl trang 136, 137, 138, 139, 140, 141, 142, 143, 144 Hóa học 11 Kết nối tri thức
- Bài 22. Ôn tập chương 5 trang 134, 135 Hóa học 11 Kết nối tri thức
- Lý thuyết Hợp chất hữu cơ và hóa học hữu cơ - Hóa học 11 Kết nối tri thức
- Bài 25. Ôn tập chương 6 trang 153, 154 Hóa học 11 Kết nối tri thức
- Bài 24. Carboxylic acid trang 145, 146, 147, 148, 149, 150, 151, 152 Hóa học 11 Kết nối tri thức
- Bài 23. Hợp chất carbonyl trang 136, 137, 138, 139, 140, 141, 142, 143, 144 Hóa học 11 Kết nối tri thức
- Bài 22. Ôn tập chương 5 trang 134, 135 Hóa học 11 Kết nối tri thức













Danh sách bình luận