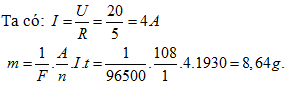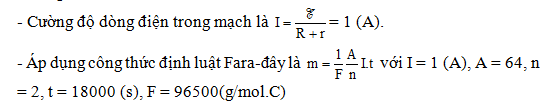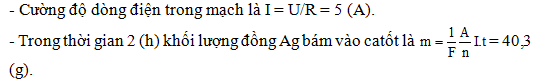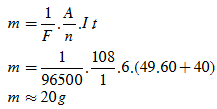40 bài tập Dòng điện trong chất điện phân mức độ vận dụng
Làm đề thiCâu hỏi 1 :
Một bình điện phân chứa dung dịch bạc nitrát, có điện trở là 5. Anốt của bình bằng bạc và hiệu điện thế đặt vào hai điện cực của bình là 20V. Tính khối lượng của bạc bám vào catốt sau 32 phút 10 giây. Biết A = 108 g/mol và
n = 1.
Lời giải chi tiết:
Câu hỏi 2 :
Một bình điện phân dung dịch CuSO4 có anốt làm bằng đồng, điện trở của bình điện phân R = 8 , được mắc vào hai cực của bộ nguồn E = 9 (V), điện trở trong r =1
. Khối lượng Cu bám vào catốt trong thời gian 5 h có giá trị là:
- A 5 (g).
- B 10,5 (g).
- C 5,97 (g).
- D 11,94 (g).
Đáp án: C
Lời giải chi tiết:
Câu hỏi 3 :
Cho dòng điện chạy qua bình điện phân đựng dung dịch muối của niken, có anôt làm bằng niken, biết nguyên tử khối và hóa trị của niken lần lượt bằng 58,71 và 2. Trong thời gian 1h dòng điện 10A đã sản ra một khối lượng niken bằng:
- A 8.10-3kg
- B 10,95 (g).
- C 12,35 (g).
- D 15,27 (g).
Đáp án: B
Câu hỏi 4 :
Cho dòng điện chạy qua bình điện phân chứa dung dịch CuSO4, có anôt bằng Cu. Biết rằng đương lượng hóa của đồng k= A/(Fn) = 3,3.10-7 kg/C. Để trên catôt xuất hiện 0,33 kg đồng, thì điện tích chuyển qua bình phải bằng:
- A 105 (C).
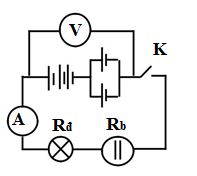
- B 106 (C).
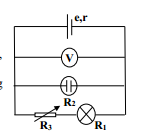
- C 5.106 (C).
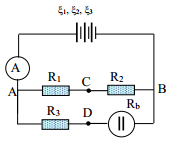
- D 107 (C).
Đáp án: B
Lời giải chi tiết:
Áp dụng công thức định luật Fara-đây là m = AIt/(Fn)=kq từ đó tính được q = 106(C).
Câu hỏi 5 :
Đặt một hiệu điện thế U = 50 (V) vào hai cực bình điện phân để điện phân một dung dịch muối ăn trong nước, người ta thu được khí hiđrô vào một bình có thể tích V = 1 (lít), áp suất của khí hiđrô trong bình bằng p = 1,3 (at) và nhiệt độ của khí hiđrô là t = 270C. Công của dòng điện khi điện phân là:
- A 50,9.105 J
- B 0,509 MJ
- C 10,18.105 J
- D 1018 kJ
Đáp án: B
Lời giải chi tiết:
Câu hỏi 6 :
Để giải phóng lượng clo và hiđrô từ 7,6g axit clohiđric bằng dòng điện 5A, thì phải cần thời gian điện phân là bao lâu? Biết rằng đương lượng điện hóa của hiđrô và clo lần lượt là: k1 = 0,1045.10-7kg/C và k2 = 3,67.10-7kg/C
- A 1,5 h
- B 1,3 h
- C 1,1 h
- D 1,0 h
Đáp án: C
Lời giải chi tiết:
Câu hỏi 7 :
Đặt một hiệu điện thế U không đổi vào hai cực của bình điện phân. Xét trong cùng một khoảng thời gian, nếu kéo hai cực của bình ra xa sao cho khoảng cách giữa chúng tăng gấp 2 lần thì khối lượng chất được giải phóng ở điện cực so với lúc trước sẽ:
- A tăng lên 2 lần.
- B giảm đi 2 lần.
- C tăng lên 4 lần.
- D giảm đi 4 lần.
Đáp án: B
Lời giải chi tiết:
Đặt một hiệu điện thế U không đổi vào hai cực của bình điện phân. Điện trở của bình điện phân được tính theo công thức: 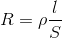 , nếu kéo hai cực của bình ra xa sao cho khoảng cách giữa chúng tăng gấp 2 lần thì điện trở của bình điện phân tăng lên 2 lần. Cường độ dòng điện qua bình điện phân giảm 2 lần.
, nếu kéo hai cực của bình ra xa sao cho khoảng cách giữa chúng tăng gấp 2 lần thì điện trở của bình điện phân tăng lên 2 lần. Cường độ dòng điện qua bình điện phân giảm 2 lần.
Xét trong cùng một khoảng thời gian, khối lượng chất được giải phóng ở điện cực so với lúc trước sẽ giảm đi 2 lần.
Câu hỏi 8 :
Chiều dày của lớp Niken phủ lên một tấm kim loại là d = 0,05(mm) sau khi điện phân trong 30 phút. Diện tích mặt phủ của tấm kim loại là 30cm2. Cho biết Niken có khối lượng riêng là r = 8,9.103 kg/m3, nguyên tử khối A = 58 và hoá trị n = 2. Cường độ dòng điện qua bình điện phân là:
- A I = 2,5 (μA).
- B I = 2,5 (mA).
- C I = 250 (A).
- D I = 2,5 (A).
Đáp án: D
Lời giải chi tiết:
Câu hỏi 9 :
Một nguồn gồm 30 pin mắc thành 3 nhóm nối tiếp, mỗi nhóm có 10 pin mắc song song, mỗi pin có suất điện động 0,9 (V) và điện trở trong 0,6 (Ω). Bình điện phân dung dịch CuSO4 có điện trở 205(Ω) mắc vào hai cực của bộ nguồn. Trong thời gian 50 phút khối lượng đồng Cu bám vào catốt là:
- A 0,013 g
- B 0,13 g
- C 1,3 g
- D 13 g
Đáp án: A
Lời giải chi tiết:
Câu hỏi 10 :
Một bình điện phân đựng dung dịch bạc nitrat với anốt bằng bạc. Điện trở của bình điện phân là R= 2 (). Hiệu điện thế đặt vào hai cực là U= 10 (V). Cho A= 108 và n=1. Khối lượng bạc bám vào cực âm sau 2 giờ là:
- A 40,3g
- B 40,3 kg
- C 8,04 g
- D 8,04.10-2 kg
Đáp án: A
Lời giải chi tiết:
Câu hỏi 11 :
Một bình điện phân đựng dung dịch bạc nitrat với anôt bằng bạc, dòng điện qua bình điện phân I = 6 (A). Xác định lượng bạc bám vào cực âm sau 49 phút 40 giây. Biết khối lượng mol của bạc là A=108 (g/mol), n = 1.
Lời giải chi tiết:
Câu hỏi 12 :
Một bình điện phân đựng dung dịch AgNO3, cường độ dòng điện chạy qua bình điện phân là I = 1 (A). Cho AAg=108 (đvc), nAg= 1. Lượng Ag bám vào catốt trong thời gian 16 phút 5 giây là:
- A 1,08 (mg).
- B 1,08 (g).
- C 0,54 (g).
- D 1,08 (kg).
Đáp án: B
Lời giải chi tiết:
với I = 1 (A), A = 108, n = 1, t = 965 (s), F = 96500 (g/mol.C)
Câu hỏi 13 :
Một bình điện phân dung dịch CuSO4 có anốt làm bằng đồng, điện trở của bình điện phân R = 8 (W), được mắc vào hai cực của bộ nguồn E = 9 (V), điện trở trong r =1 (W). Khối lượng Cu bám vào catốt trong thời gian 5 h có giá trị là:
- A 5 (g).
- B 10,5 (g).
- C 5,97 (g).
- D 11,94 (g).
Đáp án: C
Lời giải chi tiết:
Câu hỏi 14 :
Đặt một hiệu điện thế U không đổi vào hai cực của bình điện phân. Xét trong cùng một khoảng thời gian, nếu kéo hai cực của bình ra xa sao cho khoảng cách giữa chúng tăng gấp 2 lần thì khối lượng chất được giải phóng ở điện cực so với lúc trước sẽ:
- A tăng lên 2 lần.
- B giảm đi 2 lần.
- C tăng lên 4 lần.
- D giảm đi 4 lần.
Đáp án: B
Lời giải chi tiết:
Câu hỏi 15 :
Để giải phóng lượng clo và hiđrô từ 7,6g axit clohiđric bằng dòng điện 5A, thì phải cần thời gian điện phân là bao lâu? Biết rằng đương lượng điện hóa của hiđrô và clo lần lượt là: k1 = 0,1045.10-7kg/C và k2 = 3,67.10-7kg/C
- A 1,5h
- B 1,3h
- C 1,1h
- D 1,0h
Đáp án: C
Lời giải chi tiết:
Câu hỏi 16 :
Mạ kền (Niken) cho một bề mặt kim loại có diện tích 40 cm2 bằng điện phân. Sau 30 phút bề dày của lớp kền là 0,03 mm. Biết nguyên tử lượng Ni = 58, hóa trị 2, khối lượng riêng D = 8,9.103 kg/m3. Dòng điện qua bình điện phân có cường độ là
- A 3 A.
- B 1,97 A.
- C 2,5 A.
- D 1,5 A.
Đáp án: B
Phương pháp giải:
áp dụng công thức Fa – ra – đây về điện phân \(m = {{AIt} \over {Fn}}.\)
Lời giải chi tiết:
Đáp án B
+ Khối lượng kền đã được mạ\(m = Dv = DSh = 8,{9.10^3}{.40.10^{ - 4}}.0,{03.10^{ - 3}} = 1,068\,\,g.\)
Dòng điện qua bình điện phân \(m = {{AIt} \over {Fn}} \Rightarrow I = {{mFn} \over {At}} = 1,97\,\,A.\)
Câu hỏi 17 :
Một bình điện phân dung dịch CuSO4 có anot làm bằng đồng, điện trở của bình điện phân R = 8Ω, được mắc vào hai cực của bộ nguồn E = 9V, điện trở trong 1 Ω. Khối lượng đồng bám vào catot trong thời gian 5 giờ là:
- A 5g
- B 10,5g
- C 5,97g
- D 11,94g
Đáp án: C
Phương pháp giải:
Công thức Faraday về điện phân: \(m = {1 \over F}{A \over n}.It\)
Lời giải chi tiết:
Cường độ dòng điện: \(I = {E \over {R + r}} = {9 \over {8 + 1}} = 1A\)
Khối lượng đồng bám vào catot trong thời gian 5 giờ là:
\(m = {1 \over F}{A \over n}.It = {1 \over {96500}}{{64} \over 2}.1.5.3600 = 5,97g\)
Chọn C
Câu hỏi 18 :
Một bình điện phân dung dịch CuSO4 có anốt làm bằng đồng, điện trở của bình điện phân R = 8(Ω), được mắc vào hai cực của bộ nguồn E = 9(V), điện trở trong r = 1(Ω). Cho ACu = 64(đvc), nCu=2. Khối lượng Cu bám vào ca tốt trong thời gian 5h có giá trị là:
- A 5,97 g.
- B 5 g.
- C 11,94 g.
- D 10,5 g.
Đáp án: A
Phương pháp giải:
Sử dụng định luật Ôm cho toàn mạch, công thức tính khối lượng chất tạo thành ở điện cực của bình điện phân
Lời giải chi tiết:
Cường độ dòng điện chạy qua bình điện phân là \(I = {E \over {R + r}} = {9 \over {8 + 1}} = 1\left( A \right)\)
Khối lượng Cu bám vào ca tốt trong thời gian 5h là
\(m = {1 \over F}{A \over n}It = {1 \over {96500}}.{{64} \over 2}.1.5.3600 = 5,97g\)
=> Chọn đáp án A
Câu hỏi 19 :
Đương lượng điện hóa của đồng là
\(k = \frac{{1A}}{{Fn}} = 3,{3.10^{ - 7}}kg/C\)
. Nếu trên catôt của bình điện phân chứa dung dịch đồng sunfat (CuSO4) xuất hiện 0,33kg đồng thì điện lượng chạy qua bình phải là :
- A 105C
- B 106C
- C 2,5.106C
- D 0,21.107C
Đáp án: B
Phương pháp giải:
Sử dụng công thức định luật Faraday
Lời giải chi tiết:
Sử dụng công thức định luật Faraday ta có
\(m = k.q = > q = \frac{m}{k} = \frac{{0,33}}{{3,{{3.10}^{ - 7}}}} = {10^6}C\)
Câu hỏi 20 :
Để bóc một lớp đồng dày có khối lượng 8,9.10-3g, bám trên bề mặt của một tấm kim loạingười ta dùng phương pháp điện phân dương cực tan. Cường độ dòng điện qua bình điện phân là 0,01 A. Cho A = 64 g/mol và n = 2. Thời gian cần thiết là
- A 2683s
- B 1933s
- C 2318s
- D 1680s
Đáp án: A
Phương pháp giải:
Sử dụn g công thức định luật Faraday
Lời giải chi tiết:
ta có
\(m = \frac{1}{F}.\frac{A}{n}.I.t = > t = \frac{{m.F.n}}{{A.I}} = \frac{{8,{{9.10}^{ - 3}}.96500.2}}{{0,01.64}} = 2683,9s\)
Câu hỏi 21 :
Muốn mạ niken một khối trụ bằng sắt, người ta dùng khối trụ này làm catốt và nhúng chìm nó trong dung dịch muối niken của bình điện phân. Dòng điện I=10A chạy qua bình điện phân trong 1 giờ. Niken có khối lượng mol nguyên tử A=58,71 g/mol và hóa trị n=2.Khối lượng niken bám vào catốt của bìnhđiện phân là
- A 8,2.10-3kg.
- B 10,95g
- C 12,35.10-3kg.
- D 15,27g
Đáp án: B
Phương pháp giải:
Sử dụn g công thức định luật Faraday
Lời giải chi tiết:
ta có
\(m = \frac{1}{F}.\frac{A}{n}.I.t = \frac{{58,71.10.60.60}}{{96500.2}} = 10,95g\)
Câu hỏi 22 :
Hai bình điện phân mắc nối tiếp trong một mạch điện. Bình một chứa dung dịch CuSO4 có cực dương bằng Cu, bình hai chứa dung dịch AgNO3 có cực dương bằng Ag. Sau một thời gian điện phân, khối lượng cực dương của cả hai bình tăng lên 2,8 g.
a) Tính khối lượng cực dương tăng lên của mỗi bình.
b) Tính thời gian điện phân biết cường độ dòng điện trong mạch là I = 0,5A.
(Cho biết Cu = 64 hóa trị của Cu bằng 2, Ag = 108 hóa trị của Ag bằng 1)
Lời giải chi tiết:
a) m1 =\(\frac{1}{F}.\frac{{{A_1}}}{{{n_1}}}I.t\) ; m2= \(\frac{1}{F}.\frac{{{A_2}}}{{{n_2}}}I.t\)
Suy ra \(\frac{{{m_1}}}{{{m_2}}} = \frac{{{A_1}}}{{{n_1}}}.\frac{{{n_2}}}{{{A_2}}} = \frac{8}{{27}}\)(1)
Mặt khác : m1 + m2 = 2,8(2)
Giải hệ phương trình (1) và (2) ta được
m1 = 0,64 g, m2 =1,16 g
b) Thời gian điện phân:
\(t = \frac{{{m_1}.F.{n_1}}}{{{A_1}I}} = 3860s\)
Câu hỏi 23 :
a) Một bình điện phân đựng dung dịch AgNO3 với điện cực dương bằng Ag. Xác định lượng Ag bám vào điện cực âm khi cho dòng điện 2A chạy qua bình điện phân trong 16 phút 5 giây. Cho biết Ag = 108 g/mol; n = 1.
b) Cho ba pin giống nhau có suất điện động 3V, điện trở trong 0,5 Ω được mắc như hình vẽ bên. Tính suất điện động và điện trở trong của bộ nguồn
c) Khi hai điện trở giống nhau mắc nối tiếp nhau và mắc vào mạng điện có hiệu điện thế U không đổi thì công suất tiêu thụ bằng 20W. Nếu hai điện trở này mắc song song và mắc vào hiệu điện thế trên thì công suất tiêu thụ là bao nhiêu?
Phương pháp giải:
c) Sử dụng định luật Ôm cho toàn mạch,
b) kiến thức về cách mắc nguồn thành bộ,
a) định luật Faraday về hiện tượng dương cực tan
Lời giải chi tiết:
a )
Đổi 16 phút 5 giây = 965 giây
Áp dụng định luật Faraday về dương cưc tan ta có:
\(m = \frac{1}{F}.\frac{A}{n}.I.t = \frac{1}{{96500}}.\frac{{108}}{1}.2.965 = 2,16g\)
Vậy khối lượng Ag bám vào catot là 2,16g
b)
Có hai nguồn mắc song song và nối tiếp với nguồn thứ 3.
Áp dụng quy tắc về ghép nguồn thành bộ ta có
\(\begin{array}{l}
{E_b} = E + E = 2E = 6V\\
{r_b} = \frac{r}{2} + r = \frac{{0,5}}{2} + 0,5 = 0,75\Omega
\end{array}\)
c)
Khi hai điện trở mắc nối tiếp nhau thì ta có điện trở tương đương là 2R. Công suất tiêu thụ khi đó bằng
\({P_1} ={I^2}.2R = \frac{{{U^2}}}{{4R}} = 20{\rm{W}}\)
Khi hai điện trở mắc song song nhau thì ta có điện trở tương đương là R/2. Công suất tiêu thụ khi đó là:
\({P_2} = \frac{{{U^2}}}{{\frac{R}{2}}} = \frac{{2{U^2}}}{R} = 2.20 = 40W.\)
Câu hỏi 24 :
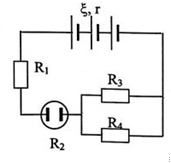
Cho mạch điện kín có bộ nguồn là 8 pin mắc nối tiếp, mỗi pin có suất điện động E0 = 1,5V, điện trở trong r0 = 0,25Ω cung cấp điện cho mạch ngoài như hình sau. Biết R1 = 2Ω, R2 là đèn (6V – 6W), R3 = 4Ω, R4 là điện trở của bình điện phân chứa dung dịch CuSO4 dương cực tan với R = 8Ω. Ampe kế có điện trở không đáng kể và vôn kế có điện trở rất lớn
a) Tính suất điện động và điện trở trong của bộ nguồn.
b) Tìm điện trở của bóng đèn và cường độ dòng điện định mức của đèn?
c) Tìm số chỉ của ampe kế và vôn kế khi đèn sáng bình thường?
d) Tính khối lượng đồng bán vào ca tốt sau 32 phút 10 giây điện phân. Biết đồng có nguyên tử lượng là 64 và hóa trị 2.
Phương pháp giải:
Áp dụng công thức định luật Ôm và công thức mắc nguồn điện thành bộ
Lời giải chi tiết:
a) Eb = 8E0 = 12V; rb = 8r0 = 2Ω
b) Rđ = Uđm2/Pđm = 6Ω
Iđm = Pđm/Uđm = 1A
c) Khi đèn sáng bình thường:
Uđ = 6V = U34
I34= U34/R34 = 6/12 = 0,5A
Cường độ dòng điện mạch chính: I = Iđ+ I34 = 1,5A = IA
Số chỉ của Vôn kế: UV = I.Rtđ = 1,5.6=9V
d) Áp dụng công thức: m = AIt/Fn = 64.0,5.1930/96500.2=0,32g
Câu hỏi 25 :
Cho mạch điện như hình vẽ. Các pin giống nhau, mỗi pin có suất điện động 3V và điện trở trong 1(Ω). Bình điện phân chứa dung dịch CuSO4, anot bằng Cu, Biết đồng có A = 64 g/mol và n = 2, điện trở của ampe kế và dây nối không đáng kể; điện trở vôn kế rất lớn ; đèn ghi (6V-12W)
a. Khi khóa K mở : Xác định số chỉ ampe kế ; vôn kế và điện trở trong của bộ nguồn?
b. Khi khóa K đóng : Đèn sáng bình thường .Sau bao lâu thì khối lượng đồng bám vào catot là0,64g và tìm số chỉ vôn kế ?
- A a) 0A; 12V; 6Ω; b) 600s; 2A
- B a) 0A; 12V; 6Ω; b) 965s; 12A
- C a) 0A; 12V; 1,75Ω; b) 965s; 2A
- D a) 2A; 12V; 3Ω; b) 2400s; 2A
Đáp án: C
Phương pháp giải:
- Pin nối tiếp: Eb = E1 + E2, rb = r1+ r2
- Pin song song: Eb = E1= E2, rb = r1 = r2
- Định luật Ôm: I = U/R
- Công thức tính khối lượng kim loại bám vào catot: m = AIt/Fn
Lời giải chi tiết:
a) K mở, mạch ngoài hở nên I = 0A
Số chỉ vôn kể: UV = Eb = 4e = 12V
Điện trở trong của nguồn: rb = 3,5r = 1,75Ω
b) K đóng:
Đèn sáng bình thường: I = Iđm = Pđm/Uđm = 12/6 = 2A
Khối lượng đồng bám vào catot m = AIt/(Fn) --> 0,64 = 64.2.t/(2.96500)--> t = 965sb
Câu hỏi 26 :
Cho mạch điện như hình vẽ: Bộ nguồn điện gồm 3 nguồn có suất điện động và điện trở trong lần lượt là E1 = E2 = 2,5V; E3 = 3V; r1 = r2 = 0,1 Ω; r3 = 0,2Ω; điện trở R1= R2 = R3 = 3Ω; Bình điện phân Rb = 6Ω, chứa dung dịch AgNO3 có cực dương bằng bạc, biết khối lượng mol nguyên tử của bạc A = 108g/mol; hóa trị n = 1. Bỏ qua điện trở của ampe kế và các dây nối.
a) Tìm suất điện động và điện trở trong của bộ nguồn?
b) Tìm số chỉ của Ampe kế và tính UCD ?
c) Tính khối lượng bạc thu được ở cực âm trong thời gian 48 phút 15 giây?
- A a) 7V; 2Ω; b) 2A; 5V c) 3,2g
- B a) 8V; 0,4Ω; b) 2A; -1,2V c) 2,592g
- C a) 9V; 0,4Ω; b) 3A; -1,2V c) 2,592g
- D a) 12V; 0,4Ω; b) 1A; -1,2V c) 2,592g
Đáp án: B
Phương pháp giải:
- Bộ nguồn mắc nối tiếp: Eb = E1 + E2+…; rb = r1 + r2 + …
- Định luật Ôm cho toàn mạch: \(I=\frac{E}{R+r}\)
- Định luật Ôm cho đoạn mạch chỉ chứa điện trở: U = IR
- Khối lượng kim loại thu được ở catot: m = AIt/F
- Điện trở mắc nối tiếp: R = R1 + R2 + …; I = I1 = I2; U = U1 + U2+ …
- Điện trở mắc song song: \(\frac{1}{R}=\frac{1}{{{R}_{1}}}+\frac{1}{{{R}_{2}}}+...\) ; I = I1+ I2 + …; U = U1= U2 =…
Lời giải chi tiết:
a) Suất điện động của bộ nguồn: Eb = E1 + E2 + E3 = 2,5+2,5+3 = 8V
Điện trở trong của bộ nguồn: r = r1 + r2 + r3 = 0,1 + 0,1 +0,2 = 0,4Ω
b) Điện trở tương đương của mạch ngoài: \(R=\frac{({{R}_{1}}+{{R}_{2}})({{R}_{3}}+{{R}_{b}})}{{{R}_{1}}+{{R}_{2}}+{{R}_{3}}+{{R}_{b}}}=\frac{(3+3).(3+6)}{3+3+3+6}=3,6\Omega \)
Số chỉ ampe kế là dòng điện mạch chính:
\({{I}_{A}}=I=\frac{{{E}_{b}}}{R+{{r}_{b}}}=\frac{8}{3,6+0,4}=2A\)
UAB = U12 = U3b = IR = 2.3,6 = 7,2V
I1 = I2 = U12/R12 = 7,2/6 = 1,2A
I3 = Ib = U3b/R3b = 7,2/9 = 0,8A
Hiệu điện thế: \({{U}_{CD}}={{U}_{CA}}+{{U}_{AD}}=-{{I}_{1}}{{R}_{1}}+{{I}_{3}}{{R}_{3}}\) = -1,2.3 + 0,8.3 = -1,2V
c) Khối lượng bạc thu được ở catot dau 48 phút 15s = 2895s là:
\(m=\frac{AIt}{Fn}=\frac{108.0,8.2895}{96500.1}=2,592g\)
Câu hỏi 27 :
Cho mạch điện như hình vẽ. Nguồn điện có suất điện động e = 14 V, điện trở trong r = 2 Ω; R1 là bóng đèn (6V-12W), R2 = 10 Ω là điện trở của bình điện phân dung dịch CuSO4 có cực dương bằng Cu. R3 là một biến trở. Vôn kế lí tưởng, A = 64, n = 2, F = 96500C/mol
a) Khi R3 = 12 Ω. Xác định: Số chỉ vôn kế. Tính khối lượng đồng giải phóng trong thời gian 32 phút 10 giây.
b) Để đèn sáng bình thường phải điều chỉnh R3 có giá trị là bao nhiêu ?
- A 10,5V; 6,72g; b) 0,75Ω
- B 9,5V; 8,72g; b) 0,75Ω
- C 10,5V; 0,672; b) 0,75Ω
- D 9,5V; 6,72g; b) 0,75Ω
Đáp án: C
Phương pháp giải:
- Định luật Ôm cho toàn mạch: \(I=\frac{e}{R+r}\)
- Định luật Ôm cho đoạn mạch chỉ chứa điện trở: U = IR
- Đoạn mạch gồm các điện trở nối tiếp: R = R1 + R2 + …; U = U1 + U2 + …; I = I1 = I2 = …
- Đoạn mạch gồm các điện trở song song: \(\frac{1}{R}=\frac{1}{{{R}_{1}}}+\frac{1}{{{R}_{2}}}+...\) ; U = U1 = U2 = …; I = I1+ I2+ …
- Công suất tiêu thụ: P = I2R = U2/R = UI
- Đèn sáng bình thường khi dòng điện qua đèn bằng các giá trị định mức.
- Khối lượng kim loại bám vào catot: m = AIt/Fn
Lời giải chi tiết:
Điện trở của đèn: Rđ = Uđm2/Pđm = 62/12 = 3Ω
a) Điện trở mạch ngoài: \({{R}_{N}}=\frac{{{R}_{2}}.({{R}_{1}}+{{R}_{3}})}{{{R}_{1}}+{{R}_{2}}+{{R}_{3}}}=6\Omega \)
Cường độ dòng điện mạch chính:
\(I=\frac{e}{{{R}_{N}}+r}=\frac{14}{6+2}=1,75A\)
Số chỉ vôn kế là hiệu điện thế giữa hai đầu mạch ngoài: U = IRN = 1,75.6 = 10,5V
Dòng điện qua R2: I2 = U2/R2 = 10,5/10 = 1,05A
Khối lượng đồng giải phóng trong 32 phút 10 giây = 1930s
\(m=\frac{AIt}{Fn}=\frac{64.1,05.1930}{96500.2}=0,672g\)
b) Đèn sáng bình thường: Iđ = I3 = Pđm/Uđm = 2A
Điện trở mạch ngoài: \({{R}_{N}}=\frac{{{R}_{2}}.({{R}_{1}}+{{R}_{3}})}{{{R}_{1}}+{{R}_{2}}+{{R}_{3}}}=\frac{10(6+{{R}_{3}})}{16+{{R}_{3}}}\)
Hiệu điện thế mạch ngoài: U = U13 = 2.R13 = 2.(6+R3)
Cường độ dòng điện mạch ngoài:
\(I=\frac{{{U}_{13}}}{{{R}_{N}}}=\frac{e}{{{R}_{N}}+r}\Rightarrow \frac{2({{R}_{3}}+6)}{\frac{10(6+{{R}_{3}})}{16+{{R}_{3}}}}=\frac{14}{\frac{10(6+{{R}_{3}})}{16+{{R}_{3}}}+2}\Rightarrow {{R}_{3}}=\) 0,75Ω
Câu hỏi 28 :
Người ta muốn bọc một lớp đồng dày d = 10 μm trên một bản đồng điện tích S = 1cm2 bằng phương pháp điện phân. Cường độ dòng điện là 0,010A. Tính thời gian cần thiết để bọc được lớp đồng. Cho biết đồng có khối lượng riêng là ρ = 8900 kg/m3.
- A 268,39s
- B 26839s
- C 2683,9s
- D 26,839s
Đáp án: C
Phương pháp giải:
Phương pháp:
Khối lượng: m = ρV; (ρ là khối lượng riêng)
Khối lượng của chất được giải phóng ra ở điện cực khi điện phân: \(m = \frac{1}{{96500}}.\frac{A}{n}.It\)
trong đó m tính bằng gam, A là khối lượng mol nguyên tử của chất, I tính bằng ampe, t tính bằng giây, n là hoá trị của nguyên tố tạo ra ion.
Lời giải chi tiết:
Cách giải:
Khối lượng đồng phải bóc đi là: \(m = \rho V = \rho .S.d = {8900.1.10^{ - 4}}{.10.10^{ - 6}} = 8,{9.10^{ - 6}}kg\)
Theo công thức Fa – ra – đây ta có:
\(m = \frac{1}{{96500}}.\frac{A}{n}.It \Rightarrow t = \frac{{96500.m.n}}{{A.I}} = \frac{{96500.8,{{9.10}^{ - 6}}.2}}{{6,{{4.10}^{ - 2}}{{.10}^{ - 2}}}} = 2683,9s\)
Chọn C
Câu hỏi 29 :
Cho mạch điện gồm 2 nguồn ghép nối tiếp, E1 = 12V, r1 = 2Ω vàE2 = 6V, r2 = 0,5Ω; bộ nguồn mắc với điện trở R = 5,5Ω là bình điện phân dung dịch CuSO4 có dương cực bằng đồng, tạo thành mạch kín. Tính khối lượng hao mòn ở atốt sau 10 phút? (Cho ACu = 64g/mol ; nCu = 2).
- A 3,2g
- B 0,45g
- C 45g
- D 32g
Đáp án: B
Phương pháp giải:
- Định luật Ôm cho toàn mạch: I = E/(r + R)
- Nguồn mắc nối tiếp: E = E1 + E2, r = r1 + r2
- Khối lượng kim loại bám vào catot: m = AIt/Fn
Lời giải chi tiết:
Suất điện động và điện trở trong của bộ nguồn:
Eb = E1 + E2 = 12 + 6 = 18V
rb = r1 + r2 = 2 + 0,5 = 2,5Ω
Cường độ dòng điện: I = E/(Rn+ r) = 18/(5,5+2,5) = 2,25A
Vậy m = AIt/Fn = 64.2,25.600/(96500.2) = 0,45g
Câu hỏi 30 :
Một vật kim loại diện tích 120 cm2 được mạ niken. Dòng điện chạy qua bình điện phân có cường độ 0,30 A và thời gian mạ là 5 giờ. Xác định độ dày của lớp niken phủ đểu trên mặt vật kim loại. Niken (Ni) có khối lượng mol là A = 58,7 g/mol, hoá trị n = 2 và khối lượng riêng D = 8,8.103kg/m3, lấy số Fa-ra-đây F = 96500 C/mol. Độ dày của lớp niken phủ đều trên mặt vật kim loại là
- A 15,6μm.
- B 1,56mm
- C 1,56μm
- D 0,156mm
Đáp án: A
Phương pháp giải:
Phương pháp:
- Khối lượng: m = ρV = ρ.S.d ; (ρ là khối lượng riêng)
- Định luật Fa – ra – đây thứ 2: Khối lượng của chất được giải phóng ra ở điện cực khi điện phân:
\(m = \frac{1}{{96500}}.\frac{A}{n}.It\)
trong đó m tính bằng gam, A là khối lượng mol nguyên tử của chất, I tính bằng ampe, t tính bằng giây, n là hoá trị của nguyên tố tạo ra ion.
Lời giải chi tiết:
Cách giải:
Công thức tính khối lượng: m = ρV = ρ.S.d
Mặt khác khối lượng niken được giải phóng ra ở catôt được tính theo công thức Fa-ra-đây :
\(m = \frac{1}{{96500}}.\frac{A}{n}.It\)
Suy ra: \(\rho .S.d = \frac{1}{{96500}}.\frac{A}{n}.It \Rightarrow d = \frac{{A.I.t}}{{96500.n.\rho S}} = \frac{{58,{{7.10}^{ - 3}}.0,3.5.3600}}{{96500.2.8,{{8.10}^3}{{.120.10}^{ - 4}}}} = 1,{56.10^{ - 5}}m = 15,6\mu m\)
Chọn A
Câu hỏi 31 :
Một ampe kế được mắc nối tiếp với bình điện phân chứa dung dịch bạc nitrat (AgN03) và số chi của nó là 0,90A. Số chỉ này có đúng không, nếu dòng điện chạy qua bình điện phân trong khoảng thời gian 5,0 phút đã giải phóng 316 mg bạc tới bám vào catôt của bình này. Đương lượng điện hoá của bạc (Ag) là 1,118 mg/C.
- A Số chỉ của ampe kế đúng
- B Số chỉ của ampe kế chưa đúng; I = 0,942A
- C Số chỉ của ampe kế chưa đúng; I = 0,842A
- D Số chỉ của ampe kế chưa đúng; I = 0,1A
Đáp án: B
Phương pháp giải:
Phương pháp:
Định luật Fa – ra – đây thứ nhất: Khối lượng vật chất được giải phóng ở điện cực của bình điện phân tỉ lệ thuận với điện lượng chạy qua bình đó: m = k.q = k.I.t
trong đó k gọi là đương lượng điện hoá của chất được giải phóng ở điện cực
Lời giải chi tiết:
Cách giải:
Theo định luật Fa – ra – đây thứ nhất về điện phân, khối lượng bạc tới bám vào cato tính bằng:
\(m{\rm{ }}k.q = k.I.t \Rightarrow I = \frac{m}{{k.t}} = \frac{{{{316.10}^{ - 3}}}}{{1,{{118.10}^{ - 3}}.5.60}} = 0,942A\)
Vậy số chỉ của ampe kế là chưa đúng
Chọn B
Câu hỏi 32 :
Một bình điện phân dung dịch bạc nitrat với anốt bằng bạc. Điện trở của bình điện phân là \(15\Omega \). Hiệu điện thế đặt vào hai cực là \(105V\). Biết \(Ag = 108g,n = 1,F = 96500\left( {C/mol} \right)\). Tính khối lượng bạc bám vào catốt sau \(2,5\) giờ điện phân.
Phương pháp giải:
+ Áp dụng biểu thức định luật Ôm: \(I = \dfrac{U}{R}\)
+ Áp dụng biểu thức định luật II Fa-ra-day: \(m = \dfrac{1}{F}\dfrac{A}{n}It\)
Lời giải chi tiết:
+ Cường độ dòng điện qua bình điện phân: \(I = \dfrac{U}{R} = \dfrac{{105}}{{15}} = 7A\)
+ Khối lượng Bạc bám vào catot sau thời gian \(t = 2,5h = 9000s\) là:
\(m = \dfrac{1}{F}\dfrac{A}{n}It = \dfrac{1}{{96500}}.\dfrac{{108}}{1}.7.9000 = 70,51g\)
Câu hỏi 33 :
Cho mạch điện như hình vẽ:
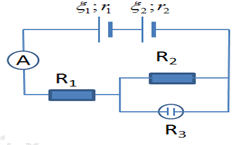
\({E_1} = {E_2} = 4,5V\), \({r_1} = {r_2} = 0,5\Omega \); \({R_1} = 2\Omega ,{R_2} = 6\Omega ,{R_3} = 3\Omega \) . \({R_3}\) là bình điện phân có điện cực làm bằng Đồng và dung dịch chất điện phân là \(CuS{O_4}\).
a. Tìm số chỉ của Ampe kế và tính hiệu điện thế mạch ngoài.
b. Tính lượng Đồng bám vào Catot của bình điện phân sau 1 giờ.
(Biết \(Cu\) có \(A = 64\); \(n = 2\))
Phương pháp giải:
a.
+ Sử dụng biểu thức của bộ nguồn mắc nối tiếp: \(\left\{ \begin{array}{l}{E_b} = {E_1} + {E_2}\\{r_b} = {r_1} + {r_2}\end{array} \right.\)
+ Sử dụng biểu thức tính điện trở tương đương của mạch có các điện trở mắc song song: \(\dfrac{1}{R} = \dfrac{1}{{{R_1}}} + \dfrac{1}{{{R_2}}}\)
+ Sử dụng biểu thức tính điện trở tương đương của mạch có các điện trở mắc nối tiếp: \(R = {R_1} + {R_2}\)
+ Áp dụng biểu thức định luật ôm cho toàn mạch: \(I = \dfrac{E}{{R + r}}\)
b. Sử dụng biểu thức định luật II Fa-ra-day: \(m = \dfrac{1}{F}\dfrac{A}{n}It\)
Lời giải chi tiết:
a.
+ Suất điện động của bộ nguồn: \({E_b} = {E_1} + {E_2} = 4,5 + 4,5 = 9V\)
+ Điện trở trong của bộ nguồn: \({r_b} = 0,5 + 0,5 = 1\Omega \)
Mạch gồm: \({R_1}nt\left( {{R_2}//{R_3}} \right)\)
\({R_{23}} = \dfrac{{{R_2}{R_3}}}{{{R_2} + {R_3}}} = \dfrac{{6.3}}{{6 + 3}} = 2\Omega \)
Điện trở tương đương mạch ngoài: \(R = {R_{23}} + {R_1} = 2 + 2 = 4\Omega \)
+ Cường độ dòng điện trong mạch: \(I = \dfrac{{{E_b}}}{{R + {r_b}}} = \dfrac{9}{{4 + 1}} = 1,8A\)
Số chỉ của ampe kế chính là giá trị của cường độ dòng điện trong mạch \(I = 1,8A\)
Hiệu điện thế mạch ngoài: \({U_N} = I.R = 1,8.4 = 7,2V\)
b.
\({U_{12}} = I{R_{12}} = 1,8.2 = 3,6V\)
Cường độ dòng điện qua bình điện phân: \({I_p} = \dfrac{{{U_p}}}{{{R_3}}} = \dfrac{{{U_{12}}}}{{{R_3}}} = \dfrac{{3,6}}{3} = 1,2A\)
Lượng Cu bám vào Catot của bình điện phân sau \(t = 1h = 3600s\) là:
\(m = \dfrac{1}{F}\dfrac{A}{n}{I_p}t = \dfrac{1}{{96500}}\dfrac{{64}}{2}1,2.3600 = 1,43g\)
Câu hỏi 34 :
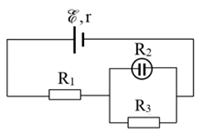
Cho mạch điện như hình vẽ: Nguồn điện có suất điện động \(E = 12V\), điện trở trong r = \(1\Omega \), \({R_2} = 12\Omega \) và là bình điện phân đựng dung dịch \(AgN{O_3}\) với điện cực anôt bằng bạc, \({R_1} = 3\Omega \), \({R_3} = 6\Omega \). Cho biết bạc (Ag) có khối lượng mol là 108g/mol, hóa trị 1, hằng số Faraday F = 96500C/mol. Khối lượng bạc bám vào catot sau thời gian 16 phút 5 giây là
- A 0,54g.
- B 0,72g.
- C 0,81g.
- D 0,27g.
Đáp án: A
Phương pháp giải:
Điện trở tương đương của đoạn mạch song song: \({R_{//}} = \dfrac{{{R_1}{R_2}}}{{{R_1} + {R_2}}}\)
Điện trở tương đương của đoạn mạch nối tiếp: \({R_{nt}} = {R_1} + {R_2}\)
Công thức định luật Ôm cho toàn mạch: \(I = \dfrac{E}{{{R_N} + r}}\)
Công thức định luật Fa-ra-đây: \(m = \dfrac{1}{F}.\dfrac{A}{n}.It\)
Lời giải chi tiết:
Cấu tạo mạch: \(\left( {{R_2}//{R_3}} \right)nt{R_1}\)
Ta có: \({R_{23}} = \dfrac{{{R_2}{R_3}}}{{{R_2} + {R_3}}} = \dfrac{{12.6}}{{12 + 6}} = 4\,\,\left( \Omega \right)\)
\( \Rightarrow {R_N} = {R_1} + {R_{23}} = 3 + 4 = 7\,\,\left( \Omega \right)\)
Áp dụng định luật Ôm cho toàn mạch, ta có:
\(I = \dfrac{E}{{{R_N} + r}} = \dfrac{{12}}{{7 + 1}} = 1,5\,\,\left( A \right) = {I_1} = {I_{23}}\)
Ta có: \({U_{23}} = {I_{23}}.{R_{23}} = 1,5.4 = 6\,\,\left( V \right) = {U_2} = {U_3}\)
\( \Rightarrow {I_2} = \dfrac{{{U_2}}}{{{R_2}}} = \dfrac{6}{{12}} = 0,5\,\,\left( A \right)\)
Khối lượng bạc bám vào catot là:
\({m_{Ag}} = \dfrac{1}{F}.\dfrac{A}{n}.{I_2}t = \dfrac{1}{{96500}}.\dfrac{{108}}{1}.0,5.\left( {16.60 + 5} \right) = 0,54\,\,\left( g \right)\)
Chọn A.
Câu hỏi 35 :
Cho mạch điện như hình vẽ:
Nguồn điện gồm 3 pin giống nhau có suất điện động ξ = 6V, điện trở trong r = 1Ω mắc nối tiếp. Điện trở R1 = 8Ω, R3 = R4 = 6Ω, R2 là bình điện phân đựng dung dịch đồng sunfat có anôt làm bằng đồng. Biết rằng trong thời gian 16 phút 5 giây lượng đồng được giải phóng là 0,32g. Cho ACu = 64, hoá trị n = 2, số Fa-ra-đây F = 96500C/mol. Tính:
a) Suất điện động và điện trở trong của bộ nguồn điện.
b) Cường độ dòng điện qua bình điện phân.
c) Hiệu suất của bộ nguồn điện.
d) Công mà bộ nguồn thực hiện trong khoảng thời gian nói trên
Phương pháp giải:
a) Bộ nguồn mắc nối tiếp: \(\left\{ \begin{array}{l}
{E_b} = n.E{\rm{ }}\\
{r_b} = n.r
\end{array} \right.\)
b) Áp dụng công thức: \(m = \frac{1}{F}\frac{A}{n}It\)
c) Áp dụng công thức: \({U_N} = {E_b} - {\rm{ }}I{r_b};H = \frac{{{{\rm{U}}_N}}}{{{E_b}}}\)
d) Công của nguồn điện : A = E.I.t
Lời giải chi tiết:
Tóm tắt :
Bộ nguồn gồm 3 pin giống nhau (E = 6V ; r = 1Ω) mắc nối tiếp.
R1 = 8Ω ; R3 = R4 = 6Ω ; R2 là bình điện phân,
t = 16 phút 5 giây ; m = 0,32g.
Cho ACu = 64, hoá trị n = 2 ; số Fa-ra-đây F = 96500C/mol.
a) Eb = ? ; rb = ?
b) Iđp.
c) Hiệu suất của bộ nguồn điện.
d) Ang = ?
Giải:
a) Suất điện động và điện trở trong của bộ nguồn mắc nối tiếp:
\(\left\{ \begin{array}{l}
{E_b} = 3.E = 18V{\rm{ }}\\
{r_b} = 3.r = 3\Omega
\end{array} \right.\)
b) Ta có :
\(m = \frac{1}{F}\frac{A}{n}It \Rightarrow I = \frac{{{\rm{m}}{\rm{.F}}{\rm{.n}}}}{{{\rm{A}}{\rm{.t}}}} = 1A\)
c) Ta có :
\({U_N} = {E_b} - {\rm{ }}I{r_b} = 15V \Rightarrow H = \frac{{{{\rm{U}}_N}}}{{{E_b}}} = \frac{{15}}{{18}} = 83,33\% \)
d) Công của nguồn điện :
\(A = {E_b}.I.t = 17370{\rm{ }}\left( J \right).\)
Câu hỏi 36 :
Một bình điện phân đựng dung dịch muối đồng sunfat CuSO4 với hai điện cực bằng đồng. Cho dòng điện một chiều chạy qua bình điện phân trong thời gian 30 phút thì thấy khối lượng catôt tăng thêm 1,143 g. Cho khối lượng mol nguyên tử của đồng là 64. Cường độ dòng điện qua bình điện phân gần với giá trị nào nhất ?
- A 0,84A
- B 1,67A
- C 0,96A
- D 1,91A
Đáp án: D
Phương pháp giải:
Áp dụng công thức Faraday về điện phân \(m = \frac{{A.I.t}}{{F.n}}\) với F = 96500 gọi là hằng số Faraday.
Lời giải chi tiết:
Áp dụng công thức Faraday về điện phân:
\(m = \frac{{A.I.t}}{{F.n}} \Rightarrow I = \frac{{m.F.n}}{{A.t}} = \frac{{1,143.96500.2}}{{64.30.60}} = 1,91A\)
với F = 96500 gọi là hằng số Faraday.
Chọn D
Câu hỏi 37 :
Khi điện phân dung dịch nhôm ôxit Al2O3 nóng chảy, người ta cho dòng điện cường độ 20 kA chạy qua dung dịch này tương ứng với hiệu điện thế giữa các điện cực là 5,0 V. Nhôm có khối lượng mol là A = 27 g/mol và hoá trị n = 3. Xác định khoảng thời gian điện phân để thu được 1 tấn nhôm và lượng điện năng đã tiêu thụ trong quá trình điện phân này bằng bao nhiêu ?
- A 5,364.1013J
- B 5,364.1010J
- C 5,364.1015J
- D 5,364.106J
Đáp án: B
Phương pháp giải:
Phương pháp:
- Định luật Fa – ra – đây thứ 2: Khối lượng của chất được giải phóng ra ở điện cực khi điện phân:
\(m = \frac{1}{{96500}}.\frac{A}{n}.It\)
trong đó m tính bằng gam, A là khối lượng mol nguyên tử của chất, I tính bằng ampe, t tính bằng giây, n là hoá trị của nguyên tố tạo ra ion.
- Điện năng tiêu thụ: W = U.I.t
Lời giải chi tiết:
Cách giải:
Khối lượng: m = 1 tấn = 1000kg = 1000 000g
Áp dụng công thức Fa-ra-đây về điện phân, ta xác định được khoảng thời gian điện phân nhôm
\(m = \frac{1}{{96500}}.\frac{A}{n}.It \Rightarrow t = \frac{{{{96500.10}^6}.3}}{{{{27.20.10}^3}}} \approx 149h\)
Điện năng tiêu thụ trong quá trình điện phân là:
\(W = UIt = {5.20.10^3}.149.3600 = 5,{364.10^{10}}J\)
Chọn B
Câu hỏi 38 :
Để mạ đồng hai mặt của một tấm sắt có diện tích mỗi mặt là 25cm2, người ta dùng nó làm catot của một bình điện phân có anot bằng đồng nhúng trong dung dịch CuSO4 rồi cho dòng điện có cường độ I = 10A chạy qua trong thời gian 1 giờ 20 phút. Biết ACu = 64, nCu = 2 và khối lượng riêng của đồng là ρCu = 8,9g/cm3. Bề dày của lớp mạ là
- A 0,0358cm
- B 0,358cm
- C 3,58cm
- D 35,8cm
Đáp án: A
Phương pháp giải:
Phương pháp:
- Khối lượng: m = ρV = ρ.S.d ; (ρ là khối lượng riêng)
- Định luật Fa – ra – đây thứ 2: Khối lượng của chất được giải phóng ra ở điện cực khi điện phân:
\(m = \frac{1}{{96500}}.\frac{A}{n}.It\)
trong đó m tính bằng gam, A là khối lượng mol nguyên tử của chất, I tính bằng ampe, t tính bằng giây, n là hoá trị của nguyên tố tạo ra ion.
Lời giải chi tiết:
Cách giải:
Đổi: t = 1 giờ 20 phút = 4800s
Thể tích của lớp đồng bám trên mỗi mặt của tấm sắt là:
Áp dụng định luật Fa – ra – đây ta có: \(m = \frac{1}{{96500}}.\frac{A}{n}.It = \frac{1}{{96500}}.\frac{{64}}{2}.10.4800 \approx 15,92g\)
Thể tích của lớp đồng bám trên mỗi mặt của tấm sắt là: \(V = \frac{m}{{2\rho }} = \frac{{15,92}}{{2.8,9}} = 0,894c{m^3}\)
Bề dày của tấm mạ: \(d = \frac{V}{S} = \frac{{0,894}}{{25}} = 0,0358cm\)
Chọn A
Câu hỏi 39 :
Mắc nối tiếp một bình điện phân chứa dung dịch đồng sunphat (CuSO4) có anôt bằng đồng (Cu) với một bình điện phân chứa dung dịch bạc nitrat (AgNO3) có anôt bằng bạc (Ag). Sau môt khoảng thời gian có dòng điện không đổi chạy qua hai bình này, thì khối lượng anôt của bình chứa dung dịch CuSO4 bị giảm bớt 2,3 g. Xác định khối lượng bạc tới bám vào catôt của bình chứa dung dịch AgNO3. Đồng có khối lượng mol là A1 = 63,5 g/mol và hoá trị n1 = 2, bạc có khối lượng mol là A2 = 108 g/mol và hoá trị n2 = 1. Khối lượng bạc tới bám vào catot của bình chứa dung dịch AgNO3 là
- A 0,67g
- B 1,95g
- C 2,66g
- D 7,82g
Đáp án: D
Phương pháp giải:
Phương pháp:
Định luật Fa – ra – đây thứ 2: Khối lượng của chất được giải phóng ra ở điện cực khi điện phân:
\(m = \frac{1}{{96500}}.\frac{A}{n}.It\)
trong đó m tính bằng gam, A là khối lượng mol nguyên tử của chất, I tính bằng ampe, t tính bằng giây, n là hoá trị của nguyên tố tạo ra ion.
Lời giải chi tiết:
Cách giải:
Hai bình điện phân đều chứa dung dịch muối của kim loại dùng làm anót và được mắc nối tiếp, nên cường độ dòng điện chạy qua chúng và thời gian điện phân là như nhau. Khi đó trong hai bình.đều xảy ra hiện tượng điện phân có dương cực tan. Kết quả là: khối lượng kim loại tan ra ở anôt được tải sang bám vào catôt trong mỗi bình điện phân.
Như vậy, khối lượng đồng m1 tan ở anôt trong bình chứa dung dịch CuSO4 và khối lượng bạc m2 bám vào catôt trong bình chứa dung dịch AgNO3 được tính theo công thức Fa-ra-đây :
\(\begin{array}{l}\left\{ \begin{array}{l}{m_1} = \frac{1}{{96500}}.\frac{{{A_1}}}{{{n_1}}}.It\\{m_2} = \frac{1}{{96500}}.\frac{{{A_2}}}{{{n_2}}}.It\end{array} \right. \Rightarrow \frac{{{m_2}}}{{{m_1}}} = \frac{{{A_2}}}{{{A_1}}}.\frac{{{n_1}}}{{{n_2}}}\\ \Rightarrow {m_2} = \frac{{{A_2}}}{{{A_1}}}.\frac{{{n_1}}}{{{n_2}}}.{m_1} = \frac{{108}}{{63,5}}.\frac{2}{1}.2,3 = 7,82g\end{array}\)
Chọn D
Câu hỏi 40 :
Bình điện phân thứ nhất có anot bằng bạc nhúng trong dung dịch AgNO3, bình điện phân thứ hai có anot bằng đồng nhúng trong dung dịch CuSO4 . Hai bình được mắc nối tiếp nhau vào một mạch điện. Sau 1,5 giờ, tổng khối lượng của hai catot tăng lên 2,1g. Cho biết AAg = 108; nAg = 1; ACu = 64; nCu = 2. Khối lượng m1 bạc bám vào bình thứ nhất và khối lượng m2 đồng bám vào bình thứ hai lần lượt là
- A 1,62g; 0,48g
- B 10,48g; 1,62g
- C 32,4g ; 9,6g
- D 9,6g; 32,4g
Đáp án: A
Phương pháp giải:
Phương pháp:
Định luật Fa – ra – đây thứ 2: Khối lượng của chất được giải phóng ra ở điện cực khi điện phân:
\(m = \frac{1}{{96500}}.\frac{A}{n}.It\)
trong đó m tính bằng gam, A là khối lượng mol nguyên tử của chất, I tính bằng ampe, t tính bằng giây, n là hoá trị của nguyên tố tạo ra ion.
Lời giải chi tiết:
Cách giải:
Đổi: t = 1,5h = 5400s
Ta có:
\(\begin{array}{l}\left\{ \begin{array}{l}{m_1} = \frac{1}{{96500}}.\frac{{{A_1}}}{{{n_1}}}.It\\{m_2} = \frac{1}{{96500}}.\frac{{{A_2}}}{{{n_2}}}.It\end{array} \right. \Rightarrow {m_1} + {m_2} = \left( {\frac{{{A_1}}}{{{n_1}}} + \frac{{{A_2}}}{{{n_2}}}} \right).\frac{{It}}{{96500}}\\ \Rightarrow I = \frac{{\left( {{m_1} + {m_2}} \right).96500}}{{\left( {\frac{{{A_1}}}{{{n_1}}} + \frac{{{A_2}}}{{{n_2}}}} \right)}} = \frac{{2,1.96500}}{{\left( {\frac{{108}}{1} + \frac{{64}}{2}} \right).5400}} = 0,268A\end{array}\)
Có I = 0,268A
\(\begin{array}{l} \Rightarrow {m_1} = \frac{1}{{96500}}.\frac{{{A_1}}}{{{n_1}}}.It = \frac{1}{{96500}}.\frac{{108}}{1}.0,268.5400 \approx 1,62g\\ \Rightarrow {m_2} = 2,1 - 1,62 = 0,48g\end{array}\)
Chọn A
>> 2K9 Học trực tuyến - Định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 11 (Xem ngay) cùng thầy cô giáo giỏi trên Tuyensinh247.com. Bứt phá điểm 9,10 chỉ sau 3 tháng, tiếp cận sớm các kì thi.
 |
 |
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- 40 bài tập Dòng điện trong chân không mức độ nhận biết, thông hiểu
- 40 bài tập Dòng điện trong chất khí mức độ nhận biết, thông hiểu
- 40 bài tập Dòng điện trong chất điện phân mức độ vận dụng
- 40 bài tập Dòng điện trong chất điện phân mức độ nhận biết, thông hiểu
- 40 bài tập dòng điện trong kim loại mức độ vận dụng
- 50 bài tập Định luật Ôm đối với toàn mạch mức độ vận dụng (Phần 2)
- 40 bài tập Dòng điện trong chân không mức độ nhận biết, thông hiểu
- 40 bài tập Dòng điện trong chất khí mức độ nhận biết, thông hiểu
- 40 bài tập Dòng điện trong chất điện phân mức độ vận dụng
- 40 bài tập Dòng điện trong chất điện phân mức độ nhận biết, thông hiểu