Câu hỏi
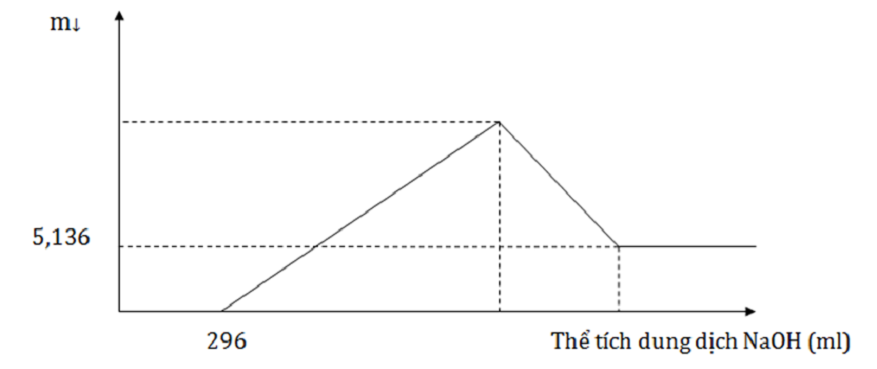
Thực hiện phản ứng nhiệt nhôm hỗn hợp Al, Fe2O3, Cr2O3 sau một thời gian thu được hỗn hợp chất rắn X. Chia X thành 2 phần bằng nhau. Hòa tan hoàn toàn phần 1 trong dung dịch H2SO4 đặc nóng, dư, sau khi các phản ứng xảy ra hoàn toàn, thu được 2,016 lít khí SO2 (sản phẩm khử duy nhất, đktc). Hòa tan hết phần 2 trong 400 ml dung dịch HNO3 2M, thu được dung dịch Y và khí NO (sản phẩm khử duy nhất, đktc). Cho từ từ dung dịch NaOH 1M đến dư vào Y thu được kết quả như hình vẽ sau:
Khối lượng Cr2O3 trong hỗn hợp ban đầu là:
- A 7,29 gam
- B 30,40 gam
- C 6,08 gam
- D 18,24 gam
Phương pháp giải:
Phần 1: nSO2 = 0,09 mol
Áp dụng bảo toàn electron ta tính được nAl
Phần 2: nHNO3 = 0,4.2 = 0,8 mol; nH+ dư = nNaOH = 0,296 mol
Áp dụng bảo toàn electron ta tính được nNO
Vậy nH+ pứ = 4.nNO + 2.nO → nO
Khi cho dung dịch NaOH dư vào Y thì Al(OH)3 và Cr(OH)3 bị hòa tan hoàn toàn. Khi đó còn lại 5,136 gam Fe(OH)3 → nFe2O3
Bảo toàn nguyên tố O ta tính được nCr2O3. Từ đó suy ra mCr2O3.
Lời giải chi tiết:
Phần 1: nSO2 = 0,09 mol
Áp dụng bảo toàn electron ta có nAl = 0,06 mol
Phần 2: nHNO3 = 0,4.2 = 0,8 mol; nH+ dư = nNaOH = 0,296 mol
Áp dụng bảo toàn electron ta có: nNO = 0,06 mol
Vậy nH+ pứ = 0,8- 0,296 = 4.nNO+ 2.nO → nO = 0,132 mol
Khi cho dung dịch NaOH dư vào Y thì Al(OH)3 và Cr(OH)3 bị hòa tan hoàn toàn. Khi đó còn lại 5,136 gam Fe(OH)3 → nFe(OH)3 = 0,048 mol → nFe2O3 = 0,024 mol
Bảo toàn nguyên tố O ta có: nO = 3.nFe2O3+ 3.nCr2O3 = 0,132 mol → nCr2O3 = 0,02 mol
Vậy khối lượng Cr2O3 ban đầu là 0,02.152.2 = 6,08 gam
Đáp án C







