Câu hỏi
Hòa tan hết hỗn hợp gồm Fe3O4 và Al2O3 (tỉ lệ mol 1:1) trong dung dịch chứa x mol HCl loãng, thu được dung dịch X. Cho dung dịch NaOH dư vào X, phản ứng được biểu diễn theo đồ thị sau:
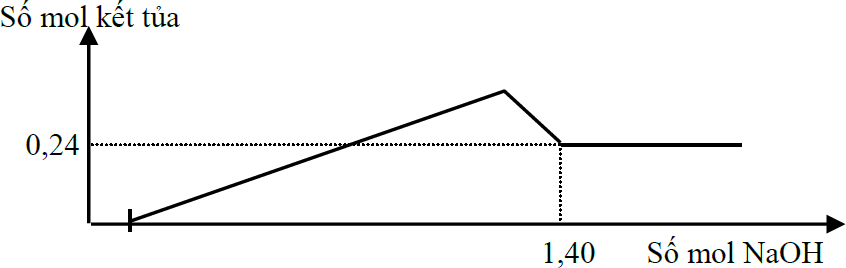
Giá trị của x là:
- A 1,12
- B 1,24
- C 1,20
- D 1,18
Phương pháp giải:
Đặt nFe3O4 = nAl2O3 = a mol
Khi Al(OH)3 bị hòa tan hết thì: nkết tủa = nFe(OH)3+ nFe(OH)2. Từ đó tìm được giá trị của a
Đồng thời khi đó: nOH- = nH+dư+ 3.nFe3++ 2.nFe2++ 4.nAl3+. Từ đó tìm được nH+ dư.
Vận dụng bảo toàn nguyên tố O và nguyên tố H ta có: nHCl = nH+ dư+ 2.nH2O. Khi đó tìm được giá trị của x.
Lời giải chi tiết:
Đặt nFe3O4 = nAl2O3 = a mol
→ nFe3+ = nAl3+ = 2a mol; nFe2+ = a mol
Khi Al(OH)3 bị hòa tan hết thì: nkết tủa = nFe(OH)3 + nFe(OH)2 = 2a + a = 0,24 mol → a = 0,08 mol
Đồng thời khi đó: nOH- = nH+dư + 3.nFe3+ + 2.nFe2+ + 4.nAl3+ = nH++ 3.2a + 2a + 4.2a = nH+ + 1,28 = 1,40 mol
→ nH+ dư = 0,12 mol
Bảo toàn nguyên tố O ta có: nH2O = nO = 4a + 3a = 0,56 mol
Bảo toàn nguyên tố H ta có: nHCl = nH+ dư+ 2.nH2O = 0,12 + 2.0,56 = 1,24 mol. Vậy x = 1,24 mol.
Đáp án B







