Câu hỏi
Nhúng một thanh kim loại M hoá trị II vào 0,5 lit dd CuSO4 0,2M. Sau một thời gian phản ứng, khối lượng thanh M tăng lên 0,40g trong khi nồng độ CuSO4 còn lại là 0,1M.
Câu 1:
a. Xác định kim loại M.
- A Zn .
- B Mg.
- C Fe.
- D Ba.
Phương pháp giải:
a. nCuSO4 (p/u) = 0,5.(0,2-0,1)= 0,05 mol
M + CuSO4 \(\xrightarrow{{}}\) MSO4 + Cu
0,05 0,05 0,05
m thanh M tăng = mCu - mM = 0,05.64 –0,05. M = 0,40 gam
=> M=?
Lời giải chi tiết:
a. nCuSO4 (p/u) = 0,5.(0,2 - 0,1)= 0,05 mol
M + CuSO4 → MSO4 + Cu
0,05 0,05 0,05
m thanh M tăng = mCu - mM = 0,05.64 –0,05. M = 0,40 gam
=> M=56 (Fe)
Đáp án C
Câu 2:
b. Lấy m(g) kim loại M cho vào 1 lit dd chứa AgNO3 và Cu(NO3)2 , nồng độ mỗi muối là 0,1M. Sau phản ứng ta thu được chất rắn A khối lượng 15,28g và dd B. Tính m(g)?
- A 6,72 (g).
- B 2,88 (g).
- C 7,8 (g).
- D 5,6 (g).
Phương pháp giải:
nAgNO3 = 0,1.1=0,1 mol
nCu(NO3)2 = 0,1.1=0,1 mol
ta chỉ biết số mol của AgNO3 và số mol của Cu(NO3)2. Nhưng không biết số mol của Fe
Ag Có Tính oxi hoá mạnh hơn Cu nên muối AgNO3 tham gia phản ứng với Fe trước.
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag (1)
Fe + Cu(NO3)2 → Fe(NO3)2 + Cu (2)
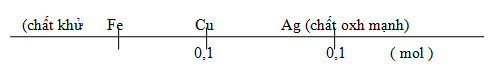
+ Giả sử xảy ra phản ứng (1): Ag kết tủa hết, Fe tan hết, Cu(NO3)2 chưa phản ứng.
Chất rắn A là Ag thì ta có: mA = 0,1 . 108 = 10,8 g
+ Giả sử xảy ra cả phản ứng (1) và (2) thì khi đó chất rắn A gồm: 0,1 mol Ag và 0,1 mol Cu
mA = 0,1 ( 108 + 64 ) = 17,2 g
theo đề cho mA = 15,28 g ta có: 10,8 < 15,28 < 17,2
=> AgNO3 phản ứng hết, Cu(NO3)2 phản ứng một phần và Fe tan hết.
Lời giải chi tiết:
b.
nAgNO3 = 0,1.1=0,1 mol
nCu(NO3)2 = 0,1.1=0,1 mol
ta chỉ biết số mol của AgNO3 và số mol của Cu(NO3)2. Nhưng không biết số mol của Fe
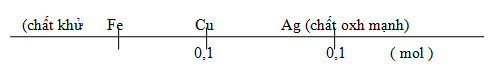
Ag Có Tính oxi hoá mạnh hơn Cu nên muối AgNO3 tham gia phản ứng với Fe trước.
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag (1)
Fe + Cu(NO3)2 → Fe(NO3)2 + Cu (2)
+ Giả sử xảy ra phản ứng (1): Ag kết tủa hết, Fe tan hết, Cu(NO3)2 chưa phản ứng.
Chất rắn A là Ag thì ta có: mA = 0,1 . 108 = 10,8 g
+ Giả sử xảy ra cả phản ứng (1) và (2) thì khi đó chất rắn A gồm: 0,1 mol Ag và 0,1 mol Cu
mA = 0,1 ( 108 + 64 ) = 17,2 g
theo đề cho mA = 15,28 g ta có: 10,8 < 15,28 < 17,2
=> AgNO3 phản ứng hết, Cu(NO3)2 phản ứng một phần và Fe tan hết.
mCu tạo ra = mA – mAg = 15,28 – 10,80 = 4,48 g => nCu = 4,48:64 = 0,07 mol.
nFe p/u = nFe (1) + nFe (2) = 0,05 + 0,07 =0,12 mol
=> mFe ban đầu = 6,72 gam
Đáp án A







