 Môn Hóa - Lớp 11
Môn Hóa - Lớp 11
 30 bài tập về xác định công thức phân tử dựa vào quá trình phân tích định lượng có lời giải
30 bài tập về xác định công thức phân tử dựa vào quá trình phân tích định lượng có lời giải
Câu hỏi
Đốt cháy hết một hidrocacbon A thu được hỗn hợp X gồm CO2 và H2O.Dẫn toàn bộ hỗn hợp X vào dung dịch Ca(OH)2 (dư) thu được 90 gam kết tủa đồng thời khối lượng dung dịch sau phản ứng giảm đi 39,6 gam. A là
- A C3H6.
- B C4H10.
- C C6H8.
- D C4H6
Phương pháp giải:
Bảo toàn nguyên tố : n C = n CO2 , n H = 2 n H2O
CxHy :
m tủa = m CaCO3 , nCaCO3 = n CO2 ,
m dd giảm = m CaCO3 –( m CO2 + m H2O )
Lời giải chi tiết:
Hướng dẫn giải :
n CaCO3 = 0,9 = nCO2 => mCO2 = 39.6 g
m dd giảm = mCaCO3 – (mCO2 + mH2O ) = 39.6
=>mH2O = 10,8 => n H2O = 0,6 mol
nC = nCO2= 0.9 mol
nH = 2nH2O = 1,2 mol
CxHy :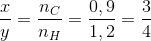 => Công thức của hidrocacbon là C6H8 ( vì ko có C3H4 )
=> Công thức của hidrocacbon là C6H8 ( vì ko có C3H4 )
Đáp án C






