Câu hỏi
Trong một bình kín dung tích không đổi chứa khí N2 và H2 với tỉ lệ thể tích 1:2. Đốt nóng bình sau một thời gian để xảy ra phản ứng N2 (k) + 3H2 (k) 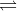 2NH3 (k). Sau đó đưa bình về nhiệt độ ban đầu thì thấy áp suất trong bình bằng 5/6 áp suất trước phản ứng. Hiệu suất của phản ứng là
2NH3 (k). Sau đó đưa bình về nhiệt độ ban đầu thì thấy áp suất trong bình bằng 5/6 áp suất trước phản ứng. Hiệu suất của phản ứng là
- A 37,5%.
- B 50,5%.
- C 75%.
- D 25%.
Phương pháp giải:
Tính toán theo PTHH.
Lời giải chi tiết:
Giả sử số mol N2 là 1 mol, số mol H2 là 2 mol, hiệu suất phản ứng là h.
N2 (k) + 3H2 (k) 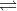 2NH3 (k)
2NH3 (k)
Bđ: 1 2 (Ta thấy: 1/1 > 2/3 => Hiệu suất tính theo H2)
Pư: 2h/3 ← 2h → 4h/3
Sau: 1-2h/3 2-2h 4h/3
Số mol khí sau phản ứng: ns = 1-2h/3 + 2 - 2h + 4h/3 = 3 - 4h/3 (mol)
Ta có: \(\frac{{{p_s}}}{{{p_d}}} = \frac{{{n_s}}}{{{n_d}}} \Rightarrow \frac{{3{\rm{ }} - {\rm{ }}\frac{{4h}}{3}}}{{1 + 2}} = \frac{5}{6} \Rightarrow h = 0,375 = 37,5\% \)
Đáp án A







