Câu hỏi
Dựa vào các thông tin được cung cấp dưới đây để trả lời các câu từ 91 đến 93
Sự điện phân là quá trình oxi hóa - khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân:
- Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
+ Gốc axit có chứa oxi không bị điện phân (ví dụ: NO3-, SO42-, PO43-, CO32-, ClO4-, …).
Khi đó nước bị điện phân theo bán phản ứng: 2H2O → O2 + 4H+ + 4e
+ Thứ tự anion bị điện phân: S2- > I- > Br- > Cl- > RCOO- > OH- > H2O
- Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
+ Nếu dung dịch có chứa nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
+ Một số cation không bị điện phân như K+, Na+, Ca2+, Ba2+, Mg2+, Al3+…
Khi đó nước bị điện phân theo bán phản ứng: 2H2O + 2e → H2 + 2OH-
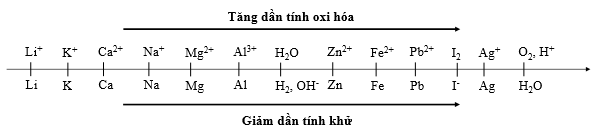
Cho dãy điện hóa sau:
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch chứa đồng thời CuSO4, Fe2(SO4)3, HNO3, Al(NO3)3 bằng hệ điện phân sử dụng các điện cực than chì cho đến khi bắt đầu thấy xuất hiện khí ở catot thì dừng điện phân.
Thí nghiệm 2: Sinh viên đó tiếp tục điện phân dung dịch hỗn hợp chứa 0,04 mol AgNO3 và 0,05 mol Cu(NO3)2 với điện cực trơ, cường độ dòng điện 5A, trong 32 phút 10 giây. Sau khi dừng điện phân, sinh viên đó nhấc catot và đem rửa sach, sấy khô và đem cân thấy khối lượng catot tăng m gam so với ban đầu. Biết hiệu suất điện phân đạt 100%. (Cho NTK: Cu = 64 đvC; Ag = 108 đvC).
Câu 1:
Trong Thí nghiệm 1, bán phản ứng nào xảy ra ở anot?
- A 2SO42- → 2SO3 + O2 + 4e.
- B 2H2O → O2 + 4H+ + 4e.
- C 2H2O + 2e → 2OH- + H2.
- D 4NO3- → 2N2O5 + O2 + 4e.
Phương pháp giải:
Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa.
Lời giải chi tiết:
Tại anot, ion SO42- và NO3- không bị điện phân → xảy ra sự điện phân H2O
Vậy bán phản ứng xảy ra ở anot là: 2H2O → O2 + 4H+ + 4e.
Chọn B.
Câu 2:
Trong Thí nghiệm 1, kim loại bám vào catot sau khi dừng điện phân là
- A Cu, Fe.
- B Cu, Fe, Al.
- C Cu.
- D Fe, Al.
Phương pháp giải:
- Khi điện phân dung dịch, ở điện cực catot:
+ Nếu dung dịch có chứa nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
+ Một số cation không bị điện phân như K+,Na+, Ca2+, Ba2+, Mg2+, Al3+… Khi đó nước bị điện phân theo bán phản ứng: 2H2O + 2e → H2 + 2OH-
- Xác định các bán phản ứng điện phân đã diễn ra tại catot ⟹ kim loại bám vào catot
Lời giải chi tiết:
Khi điện phân dung dịch, tại catot thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
Ta thấy tại catot ion Al3+ không bị điện phân nên không xét đến.
Dựa vào dãy điện hóa ta thấy tính oxi hóa: Fe3+ > Cu2+ > H+ > Fe2+
Vậy thứ tự điện phân tại catot là Fe3+, Cu2+, H+, Fe2+:
(1) Fe3+ + 1e → Fe2+
(2) Cu2+ + 2e → Cu
(3) 2H+ + 2e → H2
(4) Fe2+ + 2e → Fe
Theo đề bài, ta dừng điện phân khi bắt đầu xuất hiện khí thoát ra tại catot ⟹ bán phản ứng (2) vừa kết thúc
Các bán phản ứng đã diễn ra là:
(1) Fe3+ + 1e → Fe2+
(2) Cu2+ + 2e → Cu
Vậy sau khi dừng điện phân chỉ có kim loại Cu bám vào catot.
Chọn C.
Câu 3:
Trong Thí nghiệm 2, giá trị của m là
- A 7,24 gam.
- B 3,12 gam.
- C 6,5 gam.
- D 6,24 gam.
Phương pháp giải:
- Tính số mol e trao đổi
- Viết các bán phản ứng điện phân tại catot, đặt mol e vào và tính toán theo các bán phản ứng điện phân đó
- Xác định các kim loại bám vào catot → khối lượng catot tăng
Lời giải chi tiết:
32 phút 10 giây = 1930 giây
Số mol electron trao đổi là: \({n_e} = \frac{{It}}{F} = \frac{{5 \times 1930}}{{96500}} = 0,1\left( {mol} \right)\)
Thứ tự điện phân tại catot:
(1) Ag+ + 1e → Ag
0,04 → 0,04/0,06 → 0,04 (mol)
(2) Cu2+ + 2e → Cu
0,03/0,02 ← 0,06 → 0,03 (mol)
Vậy có 0,04 mol Ag và 0,03 mol Cu bám vào catot.
Khối lượng catot tăng là: m = 0,04.108 + 0,03.64 = 6,24 gam
Chọn D.







