Câu hỏi
Sự ăn mòn kim loại là sự phá hủy kim loại hoặc hợp kim do tác dụng của các chất trong môi trường xung quanh. Đó là một quá trình hóa học hoặc quá trình điện hóa trong đó kim loại bị oxi hóa thành ion dương.
M → Mn+ + ne
Có hai dạng ăn mòn kim loại là ăn mòn hóa học và ăn mòn điện hóa học:
- Ăn mòn hóa học là quá trình oxi hóa - khử, trong đó các electron của kim loại được chuyển trực tiếp đến các chất trong môi trường.
- Ăn mòn điện hóa học là quá trình oxi hóa - khử, trong đó kim loại bị ăn mòn do tác dụng của dung dịch chất điện li và tạo nên dòng electron chuyển dời từ cực âm đến cực dương.
Thí nghiệm 1: Nhúng thanh sắt vào dung dịch H2SO4 1M thấy bọt khí H2 thoát ra chậm.
Thí nghiệm 2: Nhúng thanh sắt và thanh đồng được nối với nhau bằng dây dẫn vào dung dịch H2SO4 1M thấy bọt khí thoát ra nhanh và mạnh hơn.
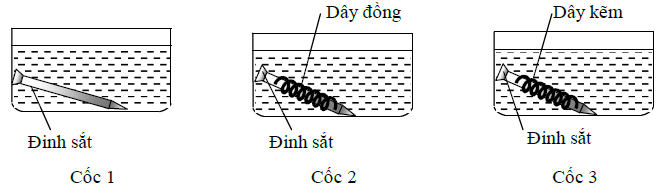
Thí nghiệm 3: Tiến hành thí nghiệm như hình vẽ sau (3 cốc đều chứa dung dịch axit HCl có cùng thể tích và nồng độ mol):
Câu 1:
Trong Thí nghiệm 1, thanh sắt bị ăn mòn theo kiểu nào sau đây?
- A Ăn mòn điện hóa học.
- B Ăn mòn hóa học.
- C Ăn mòn sinh học.
- D Ăn mòn cơ học.
Phương pháp giải:
Dựa vào định nghĩa về các loại ăn mòn kim loại.
Lời giải chi tiết:
Phản ứng xảy ra trong thí nghiệm 1:
Fe + H2SO4 → FeSO4 + H2
Quá trình cho - nhận e:
Fe → Fe2+ + 2e 2H++ 2e → H2
Ta thấy electron do Fe nhường được chuyển trực tiếp đến dung dịch H2SO4 để tạo khí H2 nên thanh sắt bị ăn mòn theo kiểu ăn mòn hóa học.
Chọn B.
Câu 2:
Trong Thí nghiệm 2, thanh sắt và thanh đồng được nối với nhau bằng dây dẫn cùng nhúng trong dung dịch chất điện li tạo thành một cặp pin điện hóa. Quá trình xảy ra tại catot của pin điện này là
- A Fe → Fe2+ + 2e.
- B Cu → Cu2+ + 2e.
- C 2H++ 2e → H2.
- D Cu2+ + 2e → Cu.
Phương pháp giải:
Trong pin điện, chất có tính khử mạnh hơn đóng vai trò anot, chất có tính khử yếu hơn đóng vai trò là catot:
- Tại anot xảy ra quá trình oxi hóa.
- Tại catot xảy ra quá trình khử.
Lời giải chi tiết:
Pin điện Fe - Cu cùng được nhúng trong dung dịch chất điện li H2SO4 thì Fe đóng vai trò anot (-) còn Cu đóng vai trò catot (+). Các bán phản ứng xảy ra tại các cực là:
- Anot (-): Fe → Fe2+ + 2e
- Catot (+): 2H+ + 2e → H2
Khí thoát ra bám vào điện cực Cu nên không ngăn cản sự tiếp xúc của Fe với H+nên ở thí nghiệm 2 khí thoát ra nhanh và mạnh hơn so với thí nghiệm 1.
Chọn C.
Câu 3:
Trong Thí nghiệm 3, đinh sắt trong cốc nào bị ăn mòn nhanh nhất?
- A Cốc 2.
- B Cốc 3.
- C Cốc 1.
- D Tốc độ ăn mòn ở cả 3 cốc như nhau do dung dịch HCl có thể tích và nồng độ mol như sau.
Phương pháp giải:
Trong pin điện hóa, kim loại đóng vai trò anot (kim loại có tính khử mạnh hơn) bị ăn mòn.
Lời giải chi tiết:
Cốc 1: Đinh sắt bị ăn mòn hóa học. Khí H2 sinh ra bám vào bề mặt của đinh sắt, ngăn cản sự tiếp xúc của đinh sắt với dung dịch HCl nên khí thoát ra chậm.
⟹ Đinh sắt bị ăn mòn chậm.
Cốc 2: Đinh sắt và dây đồng tiếp xúc trực tiếp với nhau, cùng được nhúng trong dung dịch chất điện li HCl nên có xảy ra hiện tượng ăn mòn điện hóa. Đinh sắt đóng vai trò anot (do Fe có tính khử mạnh hơn Cu) nên bị ăn mòn. Khí sinh ra trên bề mặt thanh Fe giảm nên sự tiếp xúc giữa Fe và dung dịch HCl tăng lên.
⟹ Đinh sắt bị ăn mòn nhanh.
Cốc 3: Đinh sắt và dây kẽm tiếp xúc trực tiếp với nhau, cùng được nhúng trong dung dịch chất điện li HCl nên có xảy ra hiện tượng ăn mòn điện hóa. Dây kẽm đóng vai trò anot (do Zn có tính khử mạnh hơn Fe) nên bị ăn mòn. ⟹ Đinh sắt được bảo vệ.
Vậy đinh sắt trong cốc 2 bị ăn mòn nhanh nhất.
Chọn A.







