Câu hỏi
Dựa vào các thông tin được cung cấp dưới đây để trả lời các từ 91 đến 93
Sự điện phân là quá trình oxi hóa - khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân:
+ Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
+ Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
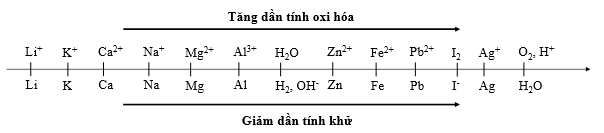
Cho dãy điện hóa sau:
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch chứa đồng thời AgNO3 và Fe(NO3)2 bằng hệ điện phân sử dụng các điện cực than chì.
Thí nghiệm 2: Sinh viên đó tiếp tục thực hiện điện phân theo sơ đồ như hình bên.
- Bình (1) chứa 200 ml dung dịch AgNO3 1M.
- Bình (2) chứa 300 ml dung dịch Fe(NO3)2 1M.
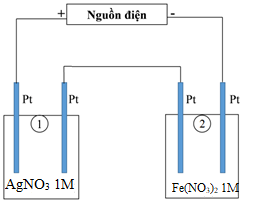
Sau một thời gian, sinh viên quan sát thấy có 8,4 gam kim loại sắt bám lên điệc cực của bình (2). Biết trong hệ điện phân nối tiếp, số điện tử truyền dẫn trong các bình là như nhau. Nguyên tử khối của Ag và Fe lần lượt là 108 và 56 đvC.
Câu 1:
Dựa theo dãy điện hóa đã cho ở trên và từ Thí nghiệm 1, hãy cho biết:
Bán phản ứng nào xảy ra đầu tiên ở catot?
- A H2O + 2e → H2 + 2OH-.
- B Fe2+ + 2e → Fe.
- C O2 + 4H+ + 4e → 2H2O
- D Ag+ + 1e → Ag.
Phương pháp giải:
Catot là nơi xảy ra quá trình khử, do vậy ion có tính oxi hóa cao sẽ bị khử trước
Dựa vào dãy điện hóa ta thấy thứ tự oxi hóa: Ag+ > Fe2+ > H2O. Do vậy Ag+ bị khử trước.
Lời giải chi tiết:
Catot là nơi xảy ra quá trình khử:
Dựa vào dãy điện hóa ta thấy thứ tự tính oxi hóa: Ag+ > Fe2+ > H2O. Do vậy Ag+ bị khử trước.
Ag+ + 1e → Ag
Chọn D.
Câu 2:
Dung dịch sau khi điện phân hoàn toàn các chất không có khả năng phản ứng với chất nào sau đây:
- A Al2O3
- B Cu
- C NaOH
- D NaCl
Phương pháp giải:
- Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa; catot của thiết bị là nơi xảy ra bán phản ứng khử.
- Từ sản phẩm của quá trình điện phân suy ra được dd chứa chất gì, từ đó chọn được đáp án chất không pư phù hợp.
Lời giải chi tiết:
Điện phân hoàn toàn, phản ứng xảy ra theo thứ tự:
Phương trình điện phân:
AgNO3 \(\xrightarrow{{dpdd}}\) Ag + O2↑ + HNO3
Fe(NO3)2 \(\xrightarrow{{dpdd}}\) Fe + O2↑ + HNO3
Sau khi điện phân hoàn toàn, dung dịch thu được có chứa HNO3
A. Có phản ứng theo PTHH: Al2O3 + 6HNO3 → 2Al(NO3)3 + 3H2O
B. Có phản ứng theo PTHH: 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
C. Có phản ứng theo PTHH: NaOH + HNO3 → NaNO3 + H2O
D. Không phản ứng vì không thỏa mãn điều kiện axit tác dụng với muối phải sinh ra chất kết tủa hoặc bay hơi.
Chọn D.
Câu 3:
Từ Thí nghiệm 2, hãy tính:
Số gam kim loại Ag bám lên điện cực trong bình (1) là
- A 21,6 gam.
- B 10,8 gam.
- C 16,2 gam
- D 32,4 gam.
Phương pháp giải:
*Bình (2): xảy ra bán phản ứng:
Fe2+ + 2e → Fe
Từ số mol của Fe tính được số mol e trao đổi ở bình (2).
Do 2 bình điện phân mắc nối tiếp nên mol electron trao đổi như nhau nên → ne (bình 1) = ne (bình 2)
*Bình (1):
So sánh ne (bình 1) với nAg+ → AgNO3 đã bị điện phân hết, H2O đang bị điện phân
Từ đó tính được lượng Ag bám vào catot bình (1).
Lời giải chi tiết:
*Bình (2):
Ta có: \({n_{F{\rm{e}}{{(N{O_3})}_2}}} = 0,3.1 = 0,3\left( {mol} \right);{n_{F{\rm{e}}}} = \frac{{8,4}}{{56}} = 0,15\left( {mol} \right)\)
Ta thấy: 2nFe < nFe(NO3)2 nên Fe(NO3)2 chưa điện phân hết, mọi tính toán theo số mol Fe
Tại catot (-):
Fe2+ + 2e → Fe
0,3 ← 0,15 (mol)
→ ne (bình 2) = 2nFe = 2.0,15 = 0,3 (mol)
Do 2 bình điện phân mắc nối tiếp nên mol electron trao đổi như nhau
→ ne (bình 1) = ne (bình 2) = 0,3 mol
*Bình (1):
Ta có: nAgNO3 = 0,2.1 = 0,2 (mol)
So sánh thấy: \({n_{e(binh\,1)}} > {n_{A{g^ + }}}\) → AgNO3 đã bị điện phân hết, H2O đang bị điện phân
Khối lượng Ag bám vào catot của bình (1) là: mAg = 0,2.108 = 21,6 gam.
Chọn A.







