Câu hỏi
Nung nóng hỗn hợp bột X gồm a mol Fe và b mol S trong khí trơ, hiệu suất phản ứng bằng 50%, thu được hỗn hợp rắn Y. Cho Y vào dung dịch HCl dư, sau khi các phản ứng xảy ra hoàn toàn, thu được hỗn hợp khí Z có tỉ khối so với H2 bằng 5. Tỉ lệ a : b bằng
- A 2 : 1
- B 1 : 1
- C 3 : 1
- D 3 : 2
Phương pháp giải:
Áp dụng phương pháp đường chéo cho hỗn hợp khí Z tính được nH2 : nH2S = 3 : 1
Ta luôn có nFe = nH2S + nH2; nH2S = nS pứ = nFe pứ
Biện luận để xác định hiệu suất phản ứng tính theo S hay theo Fe.
Từ đó tính được số mol S ban đầu và tỉ lệ a : b.
Lời giải chi tiết:
- Nung nóng hỗn hợp bột X gồm Fe và S (phản ứng có hiệu suất) thu được hỗn hợp Y:
Fe + S → FeS (1)
⟹ Hỗn hợp Y chứa FeS, Fe dư, S dư
- Cho hỗn hợp Y tác dụng với HCl dư thu được hỗn hợp khí Z:
FeS + 2HCl → FeCl2 + H2S ↑ (2)
Fe + 2HCl → FeCl2 + H2 ↑ (3)
⟹ Hỗn hợp khí Z chứa H2 và H2S
Áp dụng phương pháp đường chéo cho hỗn hợp khí Z (MZ = 5.2 = 10):
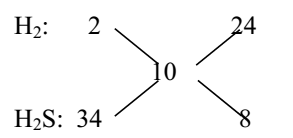
⟹ nH2 : nH2S = 24 : 8 = 3 : 1
Giả sử H2S là 1 mol thì số mol H2 là 3 mol
Theo (1) (2) ⟹ nFe pư = nFeS = nH2S = 1 mol
Theo (3) ⟹ nFe dư = nH2 = 3 mol
⟹ nFe ban đầu = nFe pư + nFe dư = 3 + 1 = 4 mol
Vì H = 50% > nFe pu/nFe = 0,25 nên hiệu suất phản ứng tính theo nguyên tố S.
Ta có: nS pư = nFeS = 1 mol ⟹ nS ban đầu = 1.(100%/H%) = 2 mol.
Vậy a : b = 4 : 2 = 2 : 1.
Đáp án A







