1. Định nghĩa acid theo thuyết acid – base của Bronsted – Lowry là gì?
Acid là chất cho proton (H+).
- Bao gồm:
+ Phân tử: HCl, HNO3, H2SO4, …
+ Cation: NH4+, CH3NH3+, ...
+ Anion: HSO4-, …
Ví dụ:
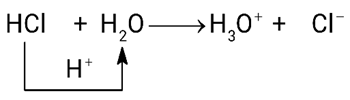 => HCl cho , HCl là acid
=> HCl cho , HCl là acid
2. Định nghĩa base theo thuyết acid – base của Bronsted – Lowry là gì?
Base là chất nhận proton.
- Bao gồm:
+ Phân tử: NaOH, KOH, …
+ Anion gốc acid của acid yếu không có khả năng nhường H+: CO32-, SO32-, S2-, PO43-,…
3. Định nghĩa chất lưỡng tính theo thuyết acid – base của Bronsted – Lowry là gì?
Chất lưỡng tính là chất vừa có khả nhường, vừa có khả năng nhận proton.
- Bao gồm:
+ Oxide, hydroxide lưỡng tính: Al2O3, Al(OH)3, ZnO, Zn(OH)2, Cr(OH)3, …
+ Gốc acid của acid yếu còn H: HCO3-, HSO3-, HS-, H2PO4-, HPO42-, …
- Muối tạo thành từ acid yếu và base yếu: (NH4)2CO3, …
4. Nhận biết acid, base, chất lưỡng tính trong phản ứng
Ví dụ 1:
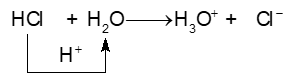
=> HCl cho \({{\rm{H}}^ + }\), HCl là acid; H2O nhận \({{\rm{H}}^ + }\), H2O là base.
Ví dụ 2:
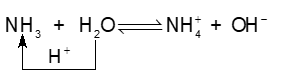
Trong phản ứng thuận, NH3 nhận \({{\rm{H}}^ + }\) của H2O, NH3 là base, H2O là acid. Trong phản ứng nghịch, ion \({\rm{NH}}_4^ + \) là acid, ion \({\rm{O}}{{\rm{H}}^ - }\) là base.
Ví dụ 3:
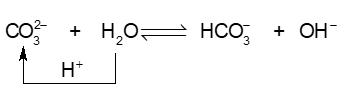
Trong phản ứng thuận,\({\rm{CO}}_3^{2 - }\)nhận \({{\rm{H}}^ + }\) của H2O, \({\rm{CO}}_3^{2 - }\)là base, H2O là acid. Trong phản ứng nghịch, ion \({\rm{HCO}}_3^ - \) là acid, ion \({\rm{O}}{{\rm{H}}^ - }\)là base.
Ví dụ 4:
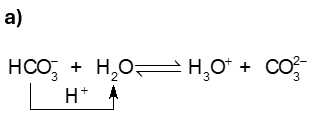
Trong phản ứng thuận, \({\rm{HCO}}_3^ - {\rm{ }}\)nhường \({{\rm{H}}^ + }\), \({\rm{HCO}}_3^ - {\rm{ }}\)là acid, H2O là base. Trong phản ứng nghịch, ion \({\rm{CO}}_3^{2 - }\)là base, ion \({{\rm{H}}_3}{{\rm{O}}^ + }\)là acid.
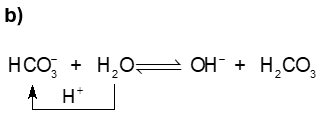
Trong phản ứng thuận, \({\rm{HCO}}_3^ - \)nhận \({{\rm{H}}^ + }\)từ H2O , \({\rm{HCO}}_3^ - {\rm{ }}\)là base, H2O là acid. Trong phản ứng nghịch, H2CO3 là acid, ion \({\rm{O}}{{\rm{H}}^ - }\)là base.
Nhận xét: Ion \({\rm{HCO}}_3^ - \), H2O vừa có thể nhận \({{\rm{H}}^ + }\), vừa có thể cho \({{\rm{H}}^ + }\)nên ion \({\rm{HCO}}_3^ - \), H2O là chất lưỡng tính.
5. Ưu điểm của thuyết Bronsted – Lowry
- Theo thuyết Arrhenius, trong phân tử acid phải có nguyên tử H, trong nước phân li ra ion H+, trong phân tử base phải có nhóm OH, trong nước phân li ra ion OH-
- Thuyết Arrhenius chỉ đúng cho trường hợp dung môi là nước. Thuyết acid – base của Bronsted – Lowry tổng quát hơn thuyết Arrhenius, phân tử không có nhóm OH- như NH3 hoặc ion \(CO_3^{2 - }\)cũng là base.

 Cân bằng hoá học - Từ điển Hoá 11
Cân bằng hoá học - Từ điển Hoá 11 






Danh sách bình luận