1. Tương tác van der Waals là gì?
Tương tác van der Waals là một loại liên kết rất yếu, hình thành do lực hút tĩnh điện giữa các cực trái dấu của các nguyên tử hay phân tử.
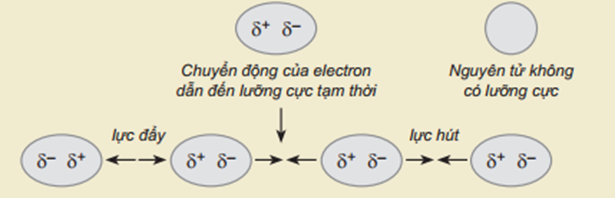
Sơ đồ mô tả sự hình thành liên kết Van der Waals
2. Ảnh hưởng của tương tác van der Waals tới tính chất vật lí của các chất
Tương tự liên kết hydrogen, tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi các chất, nhưng ở mức độ ảnh hưởng yếu hơn so với liên kết hydrogen.
Ví dụ 1: Trong dãy halogen, tương tác van der Waals tăng theo sự tăng của số electron (và proton) trong phân tử, làm tăng nhiệt độ nóng chảy, nhiệt độ sôi của các chất
Nhiệt độ nóng chảy và nhiệt độ sôi tăng khi tương tác van der Waals tăng
|
Halogen |
f2 |
Cl2 |
Br2 |
I2 |
|
Khối lượng mol (g/mol) |
38,0 |
70,9 |
159,8 |
253,8 |
|
Tổng số electron |
18 |
34 |
70 |
106 |
|
Nhiệt độ sôi (°C) |
-188,1 |
-34,1 |
59,2 |
185,5 |
|
Nhiệt độ nóng chảy (°C) |
-219,6 |
-101,0 |
-7,3 |
113,6 |
Ví dụ 2: Pentane là hydrocarbon no có công thức C5H12. Đồng phân mạch không phân nhánh pentane có nhiệt độ sôi (36 °C) cao hơn so với đồng phân mạch nhánh neopentane (9,5 °C) do diện tích tiếp xúc giữa các phân tử với neopentane.
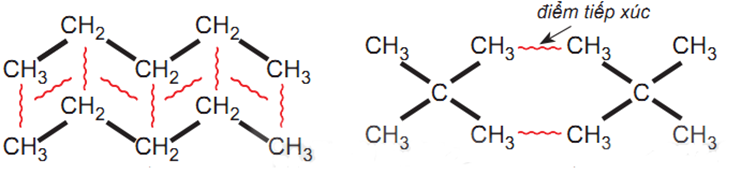
pentane neopentane
Tương tác van der Waals giữa các phân tử pentane và neopentane
=> cho thấy để phá vỡ lực liên phân tử giữa các phân tử pentane cần nhiều năng lượng hơn so với neopentane, nên nhiệt độ sôi cao hơn nhiều.

 Liên kết hoá học - Từ điển Hoá học 10
Liên kết hoá học - Từ điển Hoá học 10 






Danh sách bình luận