Trắc nghiệm Bài 5: Một số hợp chất quan trọng của nitrogen Hóa 11 Cánh diều
Đề bài
Cho các phát biểu sau:
- Ammonia lỏng được dùng làm chất làm lạnh trong thiết bị.
- Để làm khô khí NH3 có lẫn hơi nước, cho khí NH3 đi qua bình đựng dung dịch H2SO4 đậm đặc.
- Khi cho quỳ tím ẩm vào lọ đựng khí NH3, quỳ tím chuyển thành màu đỏ.
- Nitrogen lỏng được dùng để bảo quản máu và các mẫu vật sinh học.
-
A.
2.
-
B.
1.
-
C.
4.
-
D.
3.
Bình cầu chứa đầy khí ammonia khô, được úp ngược lên một chậu chứa dung dịch HCl loãng pha dung dịch quỳ có màu hồng. Nước phun lên trong bình cầu và dung dịch trong bình cầu chuyển thành màu xanh. Hiện tượng này xảy ra vì?
-
A.
Acid đã phản ứng với ammonia, làm quỳ đổi màu từ hồng sang xanh.
-
B.
Ammonia là acid yếu, làm quỳ chuyển màu xanh.
-
C.
Ammonia có tính base, tan trong nước nên áp suất giảm, nhờ đó nước có thể phun lên.
-
D.
Acid đã phản ứng khí ammonia trong bình nên áp suất giảm, nhờ đó nước có thể phun lên.
Cho hỗn hợp N2 và H2 vào bình phản ứng có nhiệt độ không đổi. Sau thời gian phản ứng, áp suất khí trong bình giảm 5% so với áp suất ban đầu. Biết ti lệ số mol của nitrogen đã phản ứng là 15%. Thành phần phần trăm về số mol của N2 và H2 trong hỗn hợp đầu?
-
A.
20% và 80%.
-
B.
16,67 và 83,33%.
-
C.
25% và 75%.
-
D.
40% và 60%.
Trong phân tử NH3 chứa liên kết?
-
A.
Liên kết cho nhận.
-
B.
Liên kết cộng hóa trị không phân cực.
-
C.
Liên kết cộng hóa trị phân cực.
-
D.
Liên kết Ion.
Phải dùng bao nhiêu lít khí Nitrogen và bao nhiêu lít khí Hydrogen để điều chế 17,0 gam NH3? Biết răng hiệu suất phản ứng tổng hợp NH3 là 20%. Các thể tích khí được đo ở đktc.
-
A.
11,2 lít N2 và 33,6 lít H2.
-
B.
11,2 lít N2 và 168 lít H2.
-
C.
56 lít N2 và 168 lít H2.
-
D.
33,6 lít N2 và 11,2 lít H2.
Cho cân bằng hóa học: \({N_{2(k)}} + 3{H_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_{3(k)}}\) ∆H = -92 kJ. Khi giảm thể tích của hỗn hợp ở trạng thái cân bằng khi nhiệt độ không đổi thì cân bằng sẽ chuyển dịch:
-
A.
Theo chiều phản ứng nghịch.
-
B.
Theo chiều phản ứng thuận.
-
C.
Không làm chuyển dịch cân bằng.
-
D.
Tùy theo mức độ giảm thể tích mà cân bằng chuyển dịch theo chiều thuận hay chiều nghịch.
NH3 thể hiện tính khử trong phản ứng hóa học nào trong các phản ứng hóa học sau?
-
A.
2NH3 + H2O--> NH4+ + OH-.
-
B.
3NH3+ AlCl3 + 3H2O → Al(OH)3 + 3NH4Cl.
-
C.
2NH3 + 3CuO → N2 + 3Cu + 3H2O.
-
D.
NH3 + HCl → NH4Cl.
Nhận xét nào sau đây về NH3 là đủ nhất?
-
A.
NH3 là một base.
-
B.
NH3 là một chất khử.
-
C.
NH3 vừa có tính khử của một chất khử vừa có tính chất của một base.
-
D.
NH3 chỉ có tính base và tính khử mà không thể hiện tính oxi hóa.
Để tách riêng NH3 ra khỏi hỗn hợp gồm N2, H2, NH3 trong công nghiệp, người ta đã:
-
A.
Cho hỗn hợp qua nước vôi trong dư.
-
B.
Cho hỗn hợp qua bột CuO nung nóng.
-
C.
Nén và làm lạnh hỗn hợp để hóa lỏng NH3.
-
D.
Cho hỗn hợp qua dung dịch H2SO4 đặc.
Trong các phản ứng sau, phản ứng nào NH3 đóng vai trò là một chất oxi hóa?
-
A.
2NH3 + H2O2+ MnSO4 → MnO2 + (NH4)2SO4.
-
B.
2NH3+ 3Cl2 → N2 + 6HCl.
-
C.
4NH3 + 5O2 → 4NO+ 6H2O.
-
D.
2NH3 + 2Na → 2NaNO3 + H2.
Hợp chất X tan trong nước tạo dung dịch không màu. Dung dịch này không tạo kết tủa với dung dịch BaCl2, khi phản ứng với NaOH tạo ra khí có mùi khai, khi phản ứng với dung dịch HCl tạo ra khí làm đục nước vôi trong và làm mất màu dung dịch thuốc tím. Chất này là
-
A.
NH4HSO3.
-
B.
Na2SO3.
-
C.
NH4HCO3.
-
D.
(NH4)2CO3.
Phản ứng giữa NH3 với chất nào sau đây chứng minh NH3 thể hiện tính base
-
A.
Cl2.
-
B.
O2.
-
C.
HCl.
-
D.
CuO.
Chất nào sau đây có thể làm khô khí NH3 có lẫn hơi nước?
-
A.
P2O5.
-
B.
H2SO4 đặc.
-
C.
CuO bột.
-
D.
NaOH rắn.
Nhận xét nào sau đây không đúng về muối ammonium?
-
A.
Muối ammonium bền với nhiệt.
-
B.
Các muối ammonium đều là chất điện li mạnh.
-
C.
Tất cả các muối ammonium đều tan trong nước.
-
D.
Các muối ammonium đều bị thủy phân trong nước.
Dãy các chất đều phản ứng với NH3 trong điều kiện thích hợp là :
-
A.
HCl, O2, Cl2, FeCl3.
-
B.
H2SO4, Ba(OH)2, FeO, NaOH.
-
C.
HCl, HNO3, AlCl3, CaO.
-
D.
KOH, HNO3, CuO, CuCl2.
Muối được làm bột nở trong thực phẩm là:
-
A.
(NH4)2CO3.
-
B.
Na2CO3.
-
C.
NH4HCO3.
-
D.
NH4Cl.
Cho phản ứng: FeO + HNO3 → Fe(NO3)3 + H2O + NO
Theo phương trình của phản ứng trên, khi hệ số của FeO là 3 thì hệ số của HNO3 là
-
A.
6.
-
B.
10.
-
C.
8.
-
D.
4.
Cho hỗn hợp Cu, Fe phản ứng với dung dịch HNO3 loãng. Sau khi phản ứng hoàn toàn, thu được dung dịch chỉ chứa một chất tan và kim loại dư. Chất tan đó là:
-
A.
Cu(NO3)2.
-
B.
HNO3.
-
C.
Fe(NO3)2.
-
D.
Fe(NO3)3.
Có các mệnh đề sau :
(1) Tác nhân chính gay mưa acid là SO2 và Nox, phát thải chủ yếu do các hoạt động công nghiệp, nhiệt điện, giao thông, khai thác và chế biến dầu mỏ...
(2) Trong phân tử nitric acid, nguyên tử N có số oxi hóa +5, là số oxi hóa cao nhất của nitrogen.
(3) Nitric acid thể hiện tính oxi hóa mạnh, có khả năng hòa tan vàng, platinum.
(4) Nitric acid tinh khiết là chất lỏng, không màu, bốc khói mạnh trong không khí ẩm và tan vô hạn trong nước.
(5) Ở dạng đậm đặc, nitric acid dược dùng để sản xuất thuốc nổ trinitrotoluene TNT.
(6) Nguyên nhân của hiện tượng phú dưỡng là do sự dư thừa nitrogen trong nước.
Trong các mệnh đề trên, số mệnh đề đúng là
-
A.
2.
-
B.
3.
-
C.
4.
-
D.
5.
HNO3 phản ứng với tất cả các chất trong nhóm nào sau đây ?
-
A.
KOH, MgCO3, Pt, FeS.
-
B.
Al(OH)3, BaCO3, BaSO4, Fe2O3.
-
C.
FeS2, Pt, SO2, HCl.
-
D.
Fe(NO3)2, S, NH4HCO3, Mg(OH)2.
Cho dãy các chất Cu, Fe, Fe2O3, FeO, CuO, MgCO3, Pt, Al(OH)3. Số chất trong dãy bị oxi hóa khi tác dụng với dung dịch HNO3 đặc, nóng là:
-
A.
4
-
B.
3.
-
C.
5.
-
D.
6.
Cho dãy các chất: FeO, Fe(OH)2, FeSO4, Fe3O4, Fe2(SO4)3, Fe2O3. Số chất trong dãy bị oxi hóa khi tác dụng với dung dịch HNO3 đặc, nóng là:
-
A.
3
-
B.
5.
-
C.
4.
-
D.
6.
Để điều chế 5 lít dung dịch HNO3 21% (D = 1,2g/ml) bằng phương pháp oxi hóa NH3 với hiệu suất toàn quá trình là 75%, thể tích khí NH3 (đktc) tối thiểu cần dùng là
-
A.
560 lít
-
B.
448 lít.
-
C.
597,33 lít.
-
D.
672 lít.
Thể tích dung dịch HNO3 1M (loãng) ít nhất cần dùng để hoà tan hoàn toàn một hỗn hợp gồm 0,015 mol Fe và 0,03 mol Cu là (biết phản ứng tạo chất khử duy nhất là NO)
-
A.
0,14 lít
-
B.
0,12 lít.
-
C.
0,06 lít.
-
D.
0,08 lít.
Cho phản ứng: Al + HNO3 → Al(NO3)3 + N2O + H2O
Trong phương trình phản ứng trên, khi hệ số của Al là 8 thì hệ số của HNO3 là?
-
A.
24.
-
B.
30.
-
C.
26.
-
D.
15.
Cho hỗn hợp Al, Fe vào dung dịch HNO3 loãng, dư thu được 6,72 lít NO (là sản phẩm khử duy nhất của N+5 ở đktc). Số mol acid đã phản ứng là?
-
A.
0,3 mol.
-
B.
0,6 mol.
-
C.
1,2 mol.
-
D.
2,4 mol.
Có các mệnh đề sau :
(1) Các muối nitrate đều tan trong nước và đều là chất điện li mạnh.
(2) Ion NO có tính oxi hóa trong môi trường acid.
(3) Khi nhiệt phân muối nitrate rắn ta đều thu được khí NO2
(4) Hầu hết muối nitrate đều bền nhiệt.
Trong các mệnh đề trên, những mệnh đề đúng là
-
A.
(1) và (3).
-
B.
(2) và (4).
-
C.
(2) và (3).
-
D.
(1) và (2).
Hoa cẩm tú cầu là loài hoa tượng trưng cho lòng biết ơn và sự chân thành, vẻ kì diệu của cẩm tú cầu là sự đổi màu ngoạn mục của nó. Màu của loài hoa này có thể thay đổi tùy thuộc vào pH của thổ nhưỡng nên có thề điểu chỉnh màu hoa thông qua việc điều chỉnh độ pH của đất trồng
| pH đất trồng | <7 | =7 | >7 |
| Màu hoa | Lam | Trắng sữa | Hồng |
-
A.
hồng – lam.
-
B.
lam – hồng.
-
C.
trắng sữa – hồng.
-
D.
hồng - trắng sữa.
HNO3 phản ứng với tất cả các chất trong nhóm nào sau đây ?
-
A.
NaOH, Al2O3, Cu2S, BaSO4.
-
B.
Cu(OH)2, BaCO3, Au, Fe2O3.
-
C.
CuS, Pt, SO2, Ag.
-
D.
Fe(NO3)2, S, NH4HCO3, Mg(OH)2.
Cho vào bình kín thể tích không đổi 0,2 mol NO và 0,3 mol O2, áp suất trong bình là P1. Saukhi phản ứng hoàn toàn đưa bình về nhiệt độ ban đầu thì áp suất là P2. Tỉ lệ của P1 và P2 là:
-
A.
P1 = 1,25P2.
-
B.
P1 = 0,8P2.
-
C.
P1 = 2P2.
-
D.
P1 = P2.
Trong các oxide của nitrogen thì oxide được điều chế trực tiếp từ phản ứng của nitrogen với oxygen là:
-
A.
N2O.
-
B.
N2O5.
-
C.
NO.
-
D.
NO2.
Phần trăm khối lượng của N trong một oxide của nó là 30,43%.Tỉ khối của A so với H2 bằng 23. Xác định CTPT của oxide đó là:
-
A.
N2O.
-
B.
N2O5.
-
C.
N2O4.
-
D.
NO2.
Lời giải và đáp án
Cho các phát biểu sau:
- Ammonia lỏng được dùng làm chất làm lạnh trong thiết bị.
- Để làm khô khí NH3 có lẫn hơi nước, cho khí NH3 đi qua bình đựng dung dịch H2SO4 đậm đặc.
- Khi cho quỳ tím ẩm vào lọ đựng khí NH3, quỳ tím chuyển thành màu đỏ.
- Nitrogen lỏng được dùng để bảo quản máu và các mẫu vật sinh học.
-
A.
2.
-
B.
1.
-
C.
4.
-
D.
3.
Đáp án : A
Dựa vào kiến thức về Ammonia và Nitrogen.
Ammonia có tính base => làm quỳ chuyển màu xanh và không thể làm khô bằng dung dịch H2SO4 đậm đặc.
H2SO4 + 2NH3 -> (NH4)2SO4
Bình cầu chứa đầy khí ammonia khô, được úp ngược lên một chậu chứa dung dịch HCl loãng pha dung dịch quỳ có màu hồng. Nước phun lên trong bình cầu và dung dịch trong bình cầu chuyển thành màu xanh. Hiện tượng này xảy ra vì?
-
A.
Acid đã phản ứng với ammonia, làm quỳ đổi màu từ hồng sang xanh.
-
B.
Ammonia là acid yếu, làm quỳ chuyển màu xanh.
-
C.
Ammonia có tính base, tan trong nước nên áp suất giảm, nhờ đó nước có thể phun lên.
-
D.
Acid đã phản ứng khí ammonia trong bình nên áp suất giảm, nhờ đó nước có thể phun lên.
Đáp án : D
Dựa vào kiến thức về Tính chất hóa học của Ammonia.
Ban đầu trong bình chứa đầy khí NH3 khô nên không có sự chênh lệch áp suất nên nước không phun được vào bình
Ammonia có tính base vì vậy phản ứng được với acid tạo muối dạng dung dịch nên làm giảm khí -> giảm áp suất trong bình
PTHH: HCl + NH3 -> NH4Cl
Do vậy áp suất trong bình giảm, nhờ đó nước có thể phun lên
Cho hỗn hợp N2 và H2 vào bình phản ứng có nhiệt độ không đổi. Sau thời gian phản ứng, áp suất khí trong bình giảm 5% so với áp suất ban đầu. Biết ti lệ số mol của nitrogen đã phản ứng là 15%. Thành phần phần trăm về số mol của N2 và H2 trong hỗn hợp đầu?
-
A.
20% và 80%.
-
B.
16,67 và 83,33%.
-
C.
25% và 75%.
-
D.
40% và 60%.
Đáp án : B
Dựa vào kiến thức về Sản xuất Ammonia.
Gọi số mol ban đầu của N2 và H2 lần lượt là x; y.
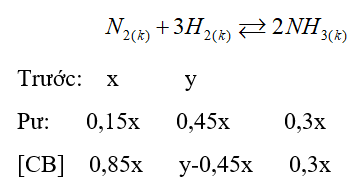
\(\frac{{{P_t}}}{{{P_s}}} = \frac{{{n_t}}}{{{n_s}}}\)=> \(\frac{{{P_t}}}{{0,95{P_t}}} = \frac{{x + y}}{{0,7x + y}}\) => 0,7x + y = 0,95(x + y)
=>y = 5x
%nN2 = \(\frac{x}{{x + y}}.100\% = \frac{x}{{x + 5x}}.100\% \)= 16,67%
%nH2 = 100% - 16,67% = 83,33%
Trong phân tử NH3 chứa liên kết?
-
A.
Liên kết cho nhận.
-
B.
Liên kết cộng hóa trị không phân cực.
-
C.
Liên kết cộng hóa trị phân cực.
-
D.
Liên kết Ion.
Đáp án : C
Dựa vào kiến thức về Tính chất hóa học của Ammonia.
Trong phân tử ammonia, liên kết N-H phân cực, cặp electron dùng chung lệch về nguyên tử nitrogen làm cho nguyên tử hydrogen mang một phần điện tích dương.
Phải dùng bao nhiêu lít khí Nitrogen và bao nhiêu lít khí Hydrogen để điều chế 17,0 gam NH3? Biết răng hiệu suất phản ứng tổng hợp NH3 là 20%. Các thể tích khí được đo ở đktc.
-
A.
11,2 lít N2 và 33,6 lít H2.
-
B.
11,2 lít N2 và 168 lít H2.
-
C.
56 lít N2 và 168 lít H2.
-
D.
33,6 lít N2 và 11,2 lít H2.
Đáp án : C
Dựa vào kiến thức về Sản xuất Ammonia.
nNH3 = \(\frac{{17}}{{17}}\) = 1 mol
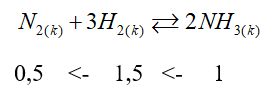
H = 20% => VH2 = \(\frac{{1,5.22,4.100}}{{20}}\) = 168 (lít)
VN2 = \(\frac{{0,5.22,4.100}}{{20}}\)= 56 (lít)
Cho cân bằng hóa học: \({N_{2(k)}} + 3{H_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_{3(k)}}\) ∆H = -92 kJ. Khi giảm thể tích của hỗn hợp ở trạng thái cân bằng khi nhiệt độ không đổi thì cân bằng sẽ chuyển dịch:
-
A.
Theo chiều phản ứng nghịch.
-
B.
Theo chiều phản ứng thuận.
-
C.
Không làm chuyển dịch cân bằng.
-
D.
Tùy theo mức độ giảm thể tích mà cân bằng chuyển dịch theo chiều thuận hay chiều nghịch.
Đáp án : B
Dựa vào kiến thức về các yếu tố ảnh hưởng đến sự chuyển dịch cân bằng hóa học.
Khi giảm thể tích hỗn hợp => áp suất hỗn hợp tăng => cân bằng chuyển dịch theo chiều giảm số mol khí (chiều thuận).
NH3 thể hiện tính khử trong phản ứng hóa học nào trong các phản ứng hóa học sau?
-
A.
2NH3 + H2O--> NH4+ + OH-.
-
B.
3NH3+ AlCl3 + 3H2O → Al(OH)3 + 3NH4Cl.
-
C.
2NH3 + 3CuO → N2 + 3Cu + 3H2O.
-
D.
NH3 + HCl → NH4Cl.
Đáp án : C
Dựa vào kiến thức về Tính chất hóa học của Ammonia.
NH3 thể hiện tính khử trong phản ứng:
\(2\mathop N\limits^{ - 3} {H_3}\; + {\rm{ }}3CuO\;{\rm{ }}\; \to \;{\rm{ }}\;{\mathop N\limits^0 _2} + {\rm{ }}3Cu{\rm{ }} + {\rm{ }}3{H_2}O\)
Nhận xét nào sau đây về NH3 là đủ nhất?
-
A.
NH3 là một base.
-
B.
NH3 là một chất khử.
-
C.
NH3 vừa có tính khử của một chất khử vừa có tính chất của một base.
-
D.
NH3 chỉ có tính base và tính khử mà không thể hiện tính oxi hóa.
Đáp án : D
Dựa vào kiến thức về Tính chất hóa học của Ammonia.
Trong phân tử ammonia, nguyên tử nitrogen có số oxi là -3 (số oxi hóa thấp nhất của nitrogen) nên ammonia chỉ thể hiện tính khử.
Để tách riêng NH3 ra khỏi hỗn hợp gồm N2, H2, NH3 trong công nghiệp, người ta đã:
-
A.
Cho hỗn hợp qua nước vôi trong dư.
-
B.
Cho hỗn hợp qua bột CuO nung nóng.
-
C.
Nén và làm lạnh hỗn hợp để hóa lỏng NH3.
-
D.
Cho hỗn hợp qua dung dịch H2SO4 đặc.
Đáp án : C
Dựa vào kiến thức về Tính chất vật lý của Ammonia.
Ammonia dễ hóa lỏng, hóa lỏng ở -33,3℃.
Trong các phản ứng sau, phản ứng nào NH3 đóng vai trò là một chất oxi hóa?
-
A.
2NH3 + H2O2+ MnSO4 → MnO2 + (NH4)2SO4.
-
B.
2NH3+ 3Cl2 → N2 + 6HCl.
-
C.
4NH3 + 5O2 → 4NO+ 6H2O.
-
D.
2NH3 + 2Na → 2NaNO3 + H2.
Đáp án : D
Dựa vào kiến thức về Tính chất hóa học của Ammonia.
Hợp chất X tan trong nước tạo dung dịch không màu. Dung dịch này không tạo kết tủa với dung dịch BaCl2, khi phản ứng với NaOH tạo ra khí có mùi khai, khi phản ứng với dung dịch HCl tạo ra khí làm đục nước vôi trong và làm mất màu dung dịch thuốc tím. Chất này là
-
A.
NH4HSO3.
-
B.
Na2SO3.
-
C.
NH4HCO3.
-
D.
(NH4)2CO3.
Đáp án : A
Dựa vào kiến thức về Tính chất hóa học của Ammonia.
- X+ NaOH sinh ra khí có mùi khai → cation là NH4+
- Dung dịch X không tạo kết tủa với dung dịch BaCl2 → gốc axit không thể là SO42−,CO32−,SO32−
- Dung dịch X + HCl sinh ra khí làm đục nước vôi trong và làm mất màu dung dịch thuốc tím → anion là HSO3−.
→ X là NH4HSO3.
Phản ứng giữa NH3 với chất nào sau đây chứng minh NH3 thể hiện tính base
-
A.
Cl2.
-
B.
O2.
-
C.
HCl.
-
D.
CuO.
Đáp án : C
Dựa vào kiến thức về Tính chất hóa học của Ammonia.
HCl + NH3 -> NH4Cl => Chọn C
Chất nào sau đây có thể làm khô khí NH3 có lẫn hơi nước?
-
A.
P2O5.
-
B.
H2SO4 đặc.
-
C.
CuO bột.
-
D.
NaOH rắn.
Đáp án : D
Dựa vào kiến thức về Tính chất hóa học của Ammonia.
Chất dùng làm khô khí NH3 có lẫn hơi nước phải là chất có đặc tính hút nước và không phản ứng với NH3.
→ Dùng NaOH rắn để làm khô khí
Nhận xét nào sau đây không đúng về muối ammonium?
-
A.
Muối ammonium bền với nhiệt.
-
B.
Các muối ammonium đều là chất điện li mạnh.
-
C.
Tất cả các muối ammonium đều tan trong nước.
-
D.
Các muối ammonium đều bị thủy phân trong nước.
Đáp án : A
Dựa vào kiến thức về Muối ammonium.
Các muối ammonium đều kém bền nhiệt và dễ bị phân hủy khi nung nóng
Dãy các chất đều phản ứng với NH3 trong điều kiện thích hợp là :
-
A.
HCl, O2, Cl2, FeCl3.
-
B.
H2SO4, Ba(OH)2, FeO, NaOH.
-
C.
HCl, HNO3, AlCl3, CaO.
-
D.
KOH, HNO3, CuO, CuCl2.
Đáp án : A
Dựa vào kiến thức về Tính chất hóa học của Ammonia.
HCl + NH3 -> NH4Cl
Cl2 + NH3 -> NH4Cl + N2
FeCl3 + NH3 + H2O -> Fe(OH)3 + 3NH4Cl
Muối được làm bột nở trong thực phẩm là:
-
A.
(NH4)2CO3.
-
B.
Na2CO3.
-
C.
NH4HCO3.
-
D.
NH4Cl.
Đáp án : C
Dựa vào kiến thức về Ứng dụng của muối Ammonium.
Cho phản ứng: FeO + HNO3 → Fe(NO3)3 + H2O + NO
Theo phương trình của phản ứng trên, khi hệ số của FeO là 3 thì hệ số của HNO3 là
-
A.
6.
-
B.
10.
-
C.
8.
-
D.
4.
Đáp án : B
Dựa vào kiến thức về Nitric acid.
3FeO + 10HNO3 → 3Fe(NO3)3 + 5H2O + NO
Cho hỗn hợp Cu, Fe phản ứng với dung dịch HNO3 loãng. Sau khi phản ứng hoàn toàn, thu được dung dịch chỉ chứa một chất tan và kim loại dư. Chất tan đó là:
-
A.
Cu(NO3)2.
-
B.
HNO3.
-
C.
Fe(NO3)2.
-
D.
Fe(NO3)3.
Đáp án : C
Dựa vào kiến thức về Nitric acid.
Chất tan duy nhất là: Fe(NO3)2
Có các mệnh đề sau :
(1) Tác nhân chính gay mưa acid là SO2 và Nox, phát thải chủ yếu do các hoạt động công nghiệp, nhiệt điện, giao thông, khai thác và chế biến dầu mỏ...
(2) Trong phân tử nitric acid, nguyên tử N có số oxi hóa +5, là số oxi hóa cao nhất của nitrogen.
(3) Nitric acid thể hiện tính oxi hóa mạnh, có khả năng hòa tan vàng, platinum.
(4) Nitric acid tinh khiết là chất lỏng, không màu, bốc khói mạnh trong không khí ẩm và tan vô hạn trong nước.
(5) Ở dạng đậm đặc, nitric acid dược dùng để sản xuất thuốc nổ trinitrotoluene TNT.
(6) Nguyên nhân của hiện tượng phú dưỡng là do sự dư thừa nitrogen trong nước.
Trong các mệnh đề trên, số mệnh đề đúng là
-
A.
2.
-
B.
3.
-
C.
4.
-
D.
5.
Đáp án : C
Dựa vào kiến thức về Một số hợp chất của nitrogen với oxygen.
Những mệnh đề đúng: (1), (2), (4), (5).
HNO3 phản ứng với tất cả các chất trong nhóm nào sau đây ?
-
A.
KOH, MgCO3, Pt, FeS.
-
B.
Al(OH)3, BaCO3, BaSO4, Fe2O3.
-
C.
FeS2, Pt, SO2, HCl.
-
D.
Fe(NO3)2, S, NH4HCO3, Mg(OH)2.
Đáp án : D
Dựa vào kiến thức về Nitric acid.
Loại A, B và C do HNO3 không phản ứng với Pt; BaSO4; HCl.
Cho dãy các chất Cu, Fe, Fe2O3, FeO, CuO, MgCO3, Pt, Al(OH)3. Số chất trong dãy bị oxi hóa khi tác dụng với dung dịch HNO3 đặc, nóng là:
-
A.
4
-
B.
3.
-
C.
5.
-
D.
6.
Đáp án : B
Dựa vào kiến thức về Nitric acid.
Các chất bị oxi hóa khi tác dụng với dung dịch HNO3 đặc, nóng: Cu, Fe, FeO.
Cho dãy các chất: FeO, Fe(OH)2, FeSO4, Fe3O4, Fe2(SO4)3, Fe2O3. Số chất trong dãy bị oxi hóa khi tác dụng với dung dịch HNO3 đặc, nóng là:
-
A.
3
-
B.
5.
-
C.
4.
-
D.
6.
Đáp án : C
Dựa vào kiến thức về Nitric acid.
Các chất bị oxi hóa khi tác dụng với dung dịch HNO3 đặc, nóng: FeO, Fe(OH)2, FeSO4, Fe3O4
Để điều chế 5 lít dung dịch HNO3 21% (D = 1,2g/ml) bằng phương pháp oxi hóa NH3 với hiệu suất toàn quá trình là 75%, thể tích khí NH3 (đktc) tối thiểu cần dùng là
-
A.
560 lít
-
B.
448 lít.
-
C.
597,33 lít.
-
D.
672 lít.
Đáp án : C
Dựa vào kiến thức về Nitric acid.
nNH3 = nHNO3 = \(\frac{{{{5.10}^3}.1,2.21}}{{100.63}}\)= 20 (mol)
H = 75% => VNH3 = \(\frac{{20.22,4.100}}{{75}}\)= 597,33 lít
Thể tích dung dịch HNO3 1M (loãng) ít nhất cần dùng để hoà tan hoàn toàn một hỗn hợp gồm 0,015 mol Fe và 0,03 mol Cu là (biết phản ứng tạo chất khử duy nhất là NO)
-
A.
0,14 lít
-
B.
0,12 lít.
-
C.
0,06 lít.
-
D.
0,08 lít.
Đáp án : A
Dựa vào kiến thức về Nitric acid.
Thể tích dung dịch HNO3 ít nhất
→ Sau phản ứng thu được Fe2+,Cu2+,NO3-
Bảo toàn electron ta có: 2nFe3++2nCu2+=3nNO
→nNO=\(\frac{{3.0,015 + 2.0,03}}{3}\)= 0,035 (mol)
→nHNO3=4nNO=0,14 (mol) => VHNO3 = 0,14 (lít)
Cho phản ứng: Al + HNO3 → Al(NO3)3 + N2O + H2O
Trong phương trình phản ứng trên, khi hệ số của Al là 8 thì hệ số của HNO3 là?
-
A.
24.
-
B.
30.
-
C.
26.
-
D.
15.
Đáp án : B
Dựa vào kiến thức về Nitric acid.
8Al + 30HNO3 → 8Al(NO3)3 + 3N2O + 15H2O
Cho hỗn hợp Al, Fe vào dung dịch HNO3 loãng, dư thu được 6,72 lít NO (là sản phẩm khử duy nhất của N+5 ở đktc). Số mol acid đã phản ứng là?
-
A.
0,3 mol.
-
B.
0,6 mol.
-
C.
1,2 mol.
-
D.
2,4 mol.
Đáp án : C
Dựa vào kiến thức về Nitric acid.
4H+ + NO3- + 3e → NO + 2H2O
nHNO3 = 4nNO = 4.\(\frac{{6,72}}{{22,4}}\)= 1,2 mol
Có các mệnh đề sau :
(1) Các muối nitrate đều tan trong nước và đều là chất điện li mạnh.
(2) Ion NO có tính oxi hóa trong môi trường acid.
(3) Khi nhiệt phân muối nitrate rắn ta đều thu được khí NO2
(4) Hầu hết muối nitrate đều bền nhiệt.
Trong các mệnh đề trên, những mệnh đề đúng là
-
A.
(1) và (3).
-
B.
(2) và (4).
-
C.
(2) và (3).
-
D.
(1) và (2).
Đáp án : D
Dựa vào kiến thức về muối nitrate
D
Hoa cẩm tú cầu là loài hoa tượng trưng cho lòng biết ơn và sự chân thành, vẻ kì diệu của cẩm tú cầu là sự đổi màu ngoạn mục của nó. Màu của loài hoa này có thể thay đổi tùy thuộc vào pH của thổ nhưỡng nên có thề điểu chỉnh màu hoa thông qua việc điều chỉnh độ pH của đất trồng
| pH đất trồng | <7 | =7 | >7 |
| Màu hoa | Lam | Trắng sữa | Hồng |
-
A.
hồng – lam.
-
B.
lam – hồng.
-
C.
trắng sữa – hồng.
-
D.
hồng - trắng sữa.
Đáp án : A
Dựa vào kiến thức về Nitric acid.
Khi trồng hoa cẩm tú cầu, nếu bón thêm ít vôi (CaO) thì khi thu hoạch hoa sẽ có màu hồng. Đó là do CaO phản ứng với nước tạo Ca(OH)2 có tính kiềm khiến cho pH đất > 7 và ở pH này hoa sẽ có màu hồng.
- Ngược lại, nếu bón NH4NO3 thì khi thu hoạch hoa sẽ có màu lam. Đó là do NH4+ phân li trong nước cho ion H+ khiến cho pH đất < 7 và ở pH này hoa sẽ có màu lam.
HNO3 phản ứng với tất cả các chất trong nhóm nào sau đây ?
-
A.
NaOH, Al2O3, Cu2S, BaSO4.
-
B.
Cu(OH)2, BaCO3, Au, Fe2O3.
-
C.
CuS, Pt, SO2, Ag.
-
D.
Fe(NO3)2, S, NH4HCO3, Mg(OH)2.
Đáp án : D
Dựa vào kiến thức về Nitric acid.
Loại A, B và C do HNO3 không phản ứng với BaSO4; Au; Pt.
Cho vào bình kín thể tích không đổi 0,2 mol NO và 0,3 mol O2, áp suất trong bình là P1. Saukhi phản ứng hoàn toàn đưa bình về nhiệt độ ban đầu thì áp suất là P2. Tỉ lệ của P1 và P2 là:
-
A.
P1 = 1,25P2.
-
B.
P1 = 0,8P2.
-
C.
P1 = 2P2.
-
D.
P1 = P2.
Đáp án : A
Dựa vào kiến thức về Các oxide của nitrogen.
2NO+ O2 → 2NO2
Tổng số mol khí trước phản ứng là n1= 0,2+ 0,3= 0,5 mol
Ta có 0,2/2 ⟨ 0,3/1 nên NO phản ứng hết và O2 còn dư
2NO+ O2 → 2NO2
Trước pứ 0,2 0,3 mol
Phản ứng 0,2 0,1 0,2 mol
Sau pứ 0 0,2 0,2 mol
Số mol khí sau phản ứng là n2= nO2+ nNO2= 0,4 mol
Do sau khi phản ứng đưa bình về nhiệt độ ban đầu nên tỉ lệ về áp suất chính là tỉ lệ về số mol.
Ta có P1/P2= n1/n2=0,5/0,4=1,25 → P1= 1,25P2
Trong các oxide của nitrogen thì oxide được điều chế trực tiếp từ phản ứng của nitrogen với oxygen là:
-
A.
N2O.
-
B.
N2O5.
-
C.
NO.
-
D.
NO2.
Đáp án : C
Dựa vào kiến thức về Các oxide của nitrogen.
N2 + O2 2NO
Phần trăm khối lượng của N trong một oxide của nó là 30,43%.Tỉ khối của A so với H2 bằng 23. Xác định CTPT của oxide đó là:
-
A.
N2O.
-
B.
N2O5.
-
C.
N2O4.
-
D.
NO2.
Đáp án : D
Dựa vào kiến thức về Các oxide của nitrogen.
Phân tử khối của A là 46. Gọi công thức của oxit là NxOy
Có: \(\frac{{\% mN}}{{\% mO}}\)= 14x/16y= 30,43/69,57
suy ra x/y= 1/2 → Công thức đơn giản nhất là NO2
Mà MA= 46→ A là NO2
Luyện tập và củng cố kiến thức Bài 6: Sulfur và sulfur dioxide Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 7: Sulfuric acid và muối sulfate Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 4: Đơn chất nitrogen Hóa 11 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết









