Bài 17. Phenol trang 82, 83, 84, 85, 86 SBT Hóa 11 Chân trời sáng tạo
Phenol là hợp chất có chứa vòng benzene, công thức cấu tạo của phenol là
17.1
Phenol là hợp chất có chứa vòng benzene, công thức cấu tạo của phenol là:
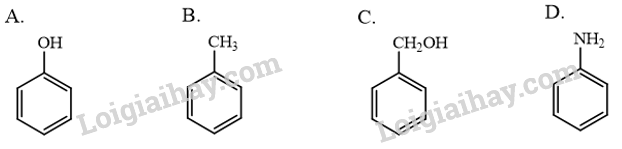
Phương pháp giải:
Phenol là hợp chất trong phân tử có một hoặc nhiều nhóm hydroxy liên kết trực tiếp với nguyên tử carbon của vòng benzene.
Lời giải chi tiết:
Công thức A có nhóm hydroxy liên kết trực tiếp với nguyên tử carbon của vòng benzene, do đó A là công thức cấu tạo của phenol.
→ Chọn A.
17.2
Trong đặc điểm cấu tạo của phenol, cặp electron trên nguyên tử oxygen bị hút một phần vào hệ thống vòng benzene, làm giàu mật độ electron ở các vị trí
A. ortho, meta. B. meta, para.
C. ortho, meta, para. D. ortho, para.
Phương pháp giải:
Mật độ electron trên nguyên tử oxygen bị dịch chuyển một phần vào vòng benzene làm tăng sự phân cực của liên kết O-H, đồng thời mật độ electron trong vòng benzene tăng ở các vị trí ortho và para, gây ra các tính chất ở nhóm –OH và trong vòng benzene của phenol.
Lời giải chi tiết:
Trong đặc điểm cấu tạo của phenol, cặp electron trên nguyên tử oxygen bị hút một phần vào hệ thống vòng benzene, làm giàu mật độ electron ở các vị trí ortho, para.
→ Chọn D.
17.3
Ở điều kiện thường, chất tồn tại ở thể rắn là
A. ethanol. B. benzene. C. phenol. D. toluene.
Phương pháp giải:
Phenol là chất rắn ở điều kiện thường.
Lời giải chi tiết:
Ở điều kiện thường:
+ Ethanol, benzene, toluene tồn tại ở thể lỏng.
+ Phenol tồn tại ở thể rắn.
→ Chọn C.
17.4
Phát biểu nào sau đây không đúng khi nói về tính chất của phenol?
A. Phenol là chất rắn, không màu hoặc màu hồng nhạt.
B. Phenol gây bỏng khi tiếp xúc với da, gây ngộ độc qua đường miệng.
C. Phenol không tan trong nước, nhưng tan trong ethanol.
D. Phenol có tính acid mạnh hơn ethanol.
Phương pháp giải:
+ Tính chất vật lí: Phenol là chất rắn, không màu; phenol độc, gây bỏng cho da. Phenol ít tan trong nước lạnh, tan vô hạn trong nước ở 66 °C, tan tốt trong ethanol. Các phenol có nhiệt độ nóng chảy, nhiệt độ sôi cao hơn các hydrocarbon thơm có khối lượng phân tử tương đương.
+ Tính chất hóa học: Phenol có tính acid yếu và phản ứng thế nguyên tử hydrogen trên vòng benzene.
Tính acid của phenol mạnh hơn ethanol.
Lời giải chi tiết:
Phát biểu C không đúng, phenol ít tan trong nước lạnh, tan vô hạn trong nước ở 66 °C, tan tốt trong ethanol.
→ Chọn C.
17.5
Chất, dung dịch tác dụng với phenol sinh ra chất khí là
A. dung dịch KOH. B. dung dịch K2CO3.
C. kim loại Na. D. kim loại Ag.
Phương pháp giải:
Phenol có tính acid yếu và phản ứng thế nguyên tử hydrogen trên vòng benzene:
+ Phenol phản ứng với dung dịch kiềm tạo muối và nước.
+ Phản ứng với kim loại kiềm (Na, K, Li…) tạo muối và khí hydrogen.
+ Phản ứng với muối carbonate của kim loại kiềm tạo muối.
Lời giải chi tiết:
Phenol phản ứng với kim loại Na tạo khí hydrogen.
\[{{\rm{C}}_{\rm{6}}}{{\rm{H}}_{\rm{5}}}{\rm{OH}} + {\rm{Na}} \to {{\rm{C}}_{\rm{6}}}{{\rm{H}}_{\rm{5}}}{\rm{ONa}} + \frac{1}{2}{{\rm{H}}_{\rm{2}}} \uparrow \]
→ Chọn C.
17.6
Sản phẩm tạo thành chất kết tủa khi cho phenol tác dụng với chất nào sau đây?
A. Dung dịch NaOH. B. Nước bromine.
C. Quỳ tím. D. Phenolphthalein.
Phương pháp giải:
Phenol phản ứng bromine tạo kết tủa trắng 2,4,6-tribromophenol.
Lời giải chi tiết:
- Phenol phản ứng bromine, làm nước bromine mất màu, tạo kết tủa trắng 2,4,6-tribromophenol.
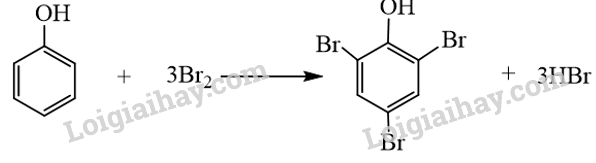
→ Chọn B.
17.7
Trường hợp nào sau đây không xảy ra phản ứng hoá học?
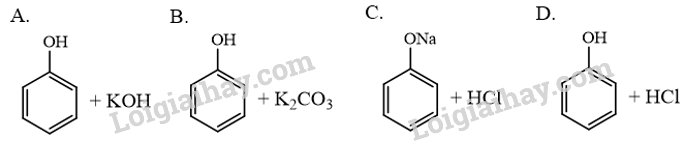
Phương pháp giải:
Phenol có tính acid yếu và phản ứng thế nguyên tử hydrogen trên vòng benzene.
- Tính acid yếu:
+ Phenol phản ứng với dung dịch kiềm tạo muối và nước.
+ Phản ứng với kim loại kiềm (Na, K, Li…) tạo muối và khí hydrogen.
+ Phản ứng với muối carbonate của kim loại kiềm tạo muối.
- Phản ứng thế nguyên tử hydrogen trên vòng benzene: với các tác nhân Br2, HNO3 thế hydrogen vào các vị trí ortho, para trên nhân benzene.
Lời giải chi tiết:
Phenol là một acid yếu nên các phản ứng ở trường hợp A và B xảy ra.
Sodium phenolate là muối của acid yếu, do đó phản ứng C xảy ra.
Trường hợp nào D không xảy ra phản ứng hoá học.
→ Chọn D.
17.8
Để nhận biết 2 chất lỏng phenol và ethanol, có thể dùng
A. dung dịch Br2. B. quỳ tím.
C. kim loại Na. D. dung dịch NaOH.
Phương pháp giải:
Phenol phản ứng bromine tạo kết tủa trắng 2,4,6-tribromophenol.
Ethanol không phản ứng với bromine.
Lời giải chi tiết:
Để nhận biết 2 chất lỏng phenol và ethanol, có thể dùng dung dịch Br2.
Phenol phản ứng với dung dịch Br2 tạo kết tủa trắng.
Ethanol không phản ứng với dung dịch Br2.
→ Chọn A.
17.9
Keo dán phenol formaldehyde (PF) có độ kết dính cao, chịu nhiệt và nước, thường được dùng để ép gỗ, dán gỗ trong xây dựng (gỗ coppha). PF là sản phẩm của phản ứng trùng ngưng giữa formaldehyde (H-CHO) với
A. ethanol (C2H5OH). B. phenol (C6H5OH).
C. benzene (C6H6). D. toluene (C6H5CH3).
Phương pháp giải:
Formaldehyde (HCHO) và phenol (C6H5OH) là hai thành phần chính tạo nên keo dán phenol formaldehyde (PF).
PF là sản phẩm của phản ứng trùng ngưng giữa formaldehyde (H-CHO) với phenol (C6H5OH).
Lời giải chi tiết:
Phenol formaldehyde (PF) là sản phẩm của phản ứng trùng ngưng giữa formaldehyde (H-CHO) với phenol (C6H5OH).
→ Chọn B.
17.10
Liều lượng được tính toán phù hợp của một số hợp chất phenol như: 4-hexylresorcinol được dùng trong thuốc giảm ho, chất trị nám; butyl paraben (HO-C6H4-COO[CH2]2CH3), BHA, BHT,... được ứng dụng làm chất bảo quản quản trong chế biến thực phẩm, mĩ phẩm, dược phẩm. Vì đặc điểm của các hợp chất này là
A. có hoạt tính sinh học. B. chi phí thấp.
C. dễ bảo quản. D. không gây độc nếu dùng dư liều lượng.
Phương pháp giải:
Phenol được sử dụng phổ biến trong lĩnh vực sản xuất như: chất sát trùng, diệt nấm, vi khuẩn, chất bảo quản, dược phẩm,...vì chúng có hoạt tính sinh học.
Lời giải chi tiết:
4-hexylresorcinol được dùng trong thuốc giảm ho, chất trị nám; butyl paraben (HO-C6H4-COO[CH2]2CH3), BHA, BHT,... được ứng dụng làm chất bảo quản quản trong chế biến thực phẩm, mĩ phẩm, dược phẩm. Vì đặc điểm của các hợp chất này là có hoạt tính sinh học.
→ Chọn A.
17.11
Xác nhận đúng hoặc sai cho các phát biểu về đặc điểm và tính chất của phenol
|
STT |
Phát biểu |
Đúng/sai |
|
1 |
Phenol có nhóm chức –OH liên kết trực tiếp với nguyên tử carbon no. |
? |
|
2 |
Phenol đơn giản nhất có chứa một nguyên tử oxygen. |
? |
|
3 |
|
? |
|
4 |
Phenol (M = 94) và toluene (M = 92) có nhiệt độ nóng chảy tương đương nhau do khối lượng phân tử gần bằng nhau. |
? |
|
5 |
Phenol tạo được liên kết hydrogen với nước. |
? |
|
6 |
Phenol có tính acid, làm quỳ tím hóa màu đỏ. |
? |
|
7 |
Phenol tham gia phản ứng cộng với Br2 tạo thành 2,4,6-tribromophenol. |
? |
Phương pháp giải:
- Phenol là hợp chất trong phân tử có một hoặc nhiều nhóm hydroxy liên kết trực tiếp với nguyên tử carbon của vòng benzene.
- Tính chất:
+ Tính chất vật lí: Phenol là chất rắn, không màu; phenol độc, gây bỏng cho da. Phenol ít tan trong nước lạnh, tan vô hạn trong nước ở 66 °C, tan tốt trong ethanol. Các phenol có nhiệt độ nóng chảy, nhiệt độ sôi cao hơn các hydrocarbon thơm có khối lượng phân tử tương đương.
+ Tính chất hóa học: Phenol có tính acid yếu và phản ứng thế nguyên tử hydrogen trên vòng benzene.
- Ứng dụng: Phenol được sử dụng phổ biến trong lĩnh vực sản xuất như: chất sát trùng, diệt nấm, vi khuẩn, chất bảo quản, chất dẻo, chất kết dính, dược phẩm, phẩm nhuộm,...
Lời giải chi tiết:
1. Phenol có nhóm chức –OH liên kết trực tiếp với nguyên tử carbon no.
→ Sai. Nhóm chức –OH liên kết trực tiếp với nguyên tử carbon trên vòng benzene, vòng benzene chứa hệ liên hợp π, carbon trên vòng benzene không phải là carbon no.
2. Phenol đơn giản nhất có chứa một nguyên tử oxygen.
→ Đúng. Phenol đơn giản nhất có công thức: C6H5OH.
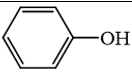
3. 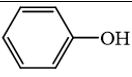 không phải là alcohol.
không phải là alcohol.
→ Đúng. Hợp chất này là phenol, không phải là alcohol vì alcohol có nhóm –OH liên kết trực tiếp với carbon no.
4. Phenol (M = 94) và toluene (M = 92) có nhiệt độ nóng chảy tương đương nhau do khối lượng phân tử gần bằng nhau.
→ Sai. Tuy hai hợp chất này có khối lượng phân tử gần bằng nhau nhưng phenol có nhiệt độ sôi cao hơn hẳn toluene vì phenol tạo được liên kết hydrogen liên phân tử còn toluen thì không.
5. Phenol tạo được liên kết hydrogen với nước.
→ Đúng. Phenol tạo được liên kết hydrogen liên phân tử và với phân tử nước.
6. Phenol có tính acid, làm quỳ tím hóa màu đỏ.
→ Sai. Phenol có tính acid yếu, không làm quỳ tím hóa đỏ.
7. Phenol tham gia phản ứng cộng với Br2 tạo thành 2,4,6-tribromophenol.
→ Sai. Phenol phản ứng thế hydrogen trên nhân benzene với bromine tạo kết tủa trắng 2,4,6-tribromophenol.
|
STT |
Phát biểu |
Đúng/sai |
|
1 |
Phenol có nhóm chức –OH liên kết trực tiếp với nguyên tử carbon no. |
Sai |
|
2 |
Phenol đơn giản nhất có chứa một nguyên tử oxygen. |
Đúng |
|
3 |
|
Đúng |
|
4 |
Phenol (M = 94) và toluene (M = 92) có nhiệt độ nóng chảy tương đương nhau do khối lượng phân tử gần bằng nhau. |
Sai |
|
5 |
Phenol tạo được liên kết hydrogen với nước. |
Đúng |
|
6 |
Phenol có tính acid, làm quỳ tím hóa màu đỏ. |
Sai |
|
7 |
Phenol tham gia phản ứng cộng với Br2 tạo thành 2,4,6-tribromophenol. |
Sai |
17.12
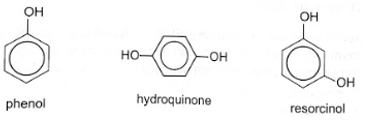
So sánh nhiệt độ nóng chảy của 3 chất phenol, hydroquinone (4-hydroxyphenol) và resorcinol (3-hydroxyphenol). Giải thích.
Phương pháp giải:
Hợp chất có khối lượng phân tử lớn hơn, tương tác van der Waals mạnh hơn, nhiệt độ nhiệt độ nóng chảy cao hơn. Hợp chất tạo được nhiều liên kết hydrogen hơn nên nhiệt độ nóng chảy cao. Hợp chất có tính đối xứng hơn sẽ có nhiệt độ nóng chảy cao hơn.
Lời giải chi tiết:
Trong nhiều trường hợp, có thể dựa vào khối lượng phân tử và số nhóm chức –OH trong hợp chất phenol để so sánh nhiệt độ nóng chảy của các hợp chất. So với phenol, hydroquinone và resorcinol có khối lượng phân tử lớn hơn, tương tác van der Waals mạnh hơn; số nhóm chức –OH nhiều hơn, hình thành nhiều liên kết hydrogen hơn nên nhiệt độ nóng chảy của hydroquinone và resorcinol cao hơn phenol.
Đối với hydroquinone và resorcinol, nhiệt độ nóng chảy của các hợp chất còn phụ thuộc vào vị trí nhóm thế trên vòng benzene, hợp chất có tính đối xứng hơn sẽ có nhiệt độ nóng chảy cao hơn. Resorcinol (3-hydroxyphenol) và hydroquinone (4-hydroxyphenol) và đều có cùng khối lượng phân tử và số nhóm -OH, nhưng hydroquinone có nhiệt độ nóng chảy 172 C (do tính đối xứng trong phân tử), trong khi resorcinol là 110 °C.
Vậy nhiệt độ nóng chảy của các chất theo thứ tự tăng dần là: phenol, resorcinol, hydroquinone.
17.13
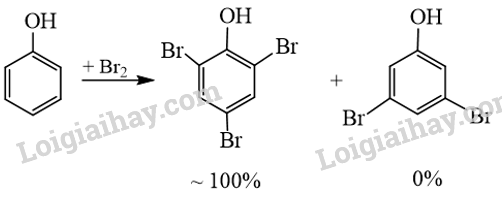
Trong thí nghiệm của phenol với nước Br2, thu được sản phẩm hữu cơ 2,4,6-tribromophenol (kết tủa màu trắng) đạt gần 100% và không thu được các sản phẩm thế bromo khác ở các vị trí còn lại của phenol. Giải thích. Cho sơ đồ minh hoạ như sau:
Phương pháp giải:
Mật độ electron trên nguyên tử oxygen bị dịch chuyển một phần vào vòng benzene làm tăng sự phân cực của liên kết O-H, đồng thời mật độ electron trong vòng benzene tăng, nhiều nhất ở các vị trí 2, 4, 6.
Lời giải chi tiết:
Cặp electron của nguyên tử oxygen liên hợp với hệ thống electron vòng benzene, làm tăng mật độ electron vòng benzene, nhiều nhất ở các vị trí 2, 4, 6. Do đó khi tham gia phản ứng thế với nước Br2, phenol ưu tiên thế các nguyên tử hydrogen ở vị trí 2, 4, 6.
17.14
Trong công nghiệp, ngoài phương pháp điều chế phenol từ cumene hoặc từ nhựa than đá, người ta còn thực hiện điều chế bằng phản ứng thuỷ phân dẫn xuất chlorobenzene với dung dịch NaOH đặc, ở nhiệt độ 350 °C, áp suất cao (quy trình Dow), sản phẩm hữu cơ là muối sodium phenolate, acid hoá bằng dung dịch HCl, thu được phenol.
a) Viết phương trình hoá học của các phản ứng xảy ra.
b) Tại sao khi thuỷ phân chlorobenzene không tạo thành sản phẩm trực tiếp phenol, mà tạo thành sodium phenolate?
Phương pháp giải:
a) Phương trình 1: thuỷ phân dẫn xuất chlorobenzene với dung dịch NaOH đặc, ở nhiệt độ 350 °C, áp suất cao, sản phẩm hữu cơ là muối sodium phenolate.
Phương trình 2: acid hoá sodium phenolate hoá bằng dung dịch HCl, thu được phenol.
b) Phenol có tính acid, phản ứng với NaOH tạo muối sodium phenolate.
Lời giải chi tiết:
a) Các phương trình hoá học của các phản ứng xảy ra:
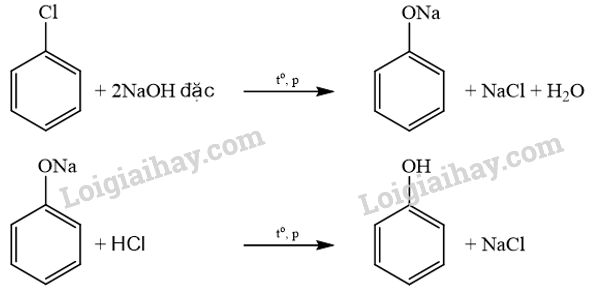
b) Chlorobenzene tác dụng với NaOH, xảy ra phản ứng thế Cl bằng nhóm –OH tạo thành phenol, là một acid, phenol tác dụng với NaOH tạo thành muối sodium phenolate ngay sau đó.
C6H5OH + NaOH → C6H5ONa + H2O
17.15
Hằng số phân li acid Ka của một số hợp chất được thể hiện trong bảng dưới đây:
|
Hợp chất |
Ka (phân li trong H2O, 25 oC) |
|
Phenol |
\[1,0 \times {10^{ - 10}}\] |
|
2-methylphenol |
\[6,3 \times {10^{ - 11}}\] |
|
2-chlorophenol |
\[7,8 \times {10^{ - 9}}\] |
|
2-nitrophenol |
\[6,8 \times {10^{ - 8}}\] |
|
2,4-dinitrophenol |
\[1,1 \times {10^{ - 4}}\] |
|
2,4,6-trinitrophenol (acid picric) |
\[0,4\] |
|
Carbonic acid \[\begin{array}{l}{{\rm{H}}_{\rm{2}}}{\rm{C}}{{\rm{O}}_3} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{HCO}}_3^ - + {{\rm{H}}^ + }\\{\rm{HCO}}_3^ - \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{CO}}_3^{2 - } + {{\rm{H}}^ + }\end{array}\] |
\[\begin{array}{l}5,0 \times {10^{ - 7}}\\5,0 \times {10^{ - 11}}\end{array}\] |
a) Sắp xếp theo thứ tự giảm dần tính acid của các hợp chất phenol.
b) Trong các chất trên, chất nào tác dụng được với Na2CO3 sinh ra khí CO2? Giải thích.
Phương pháp giải:
a) Hằng số phân li acid (KC) càng lớn, tính acid càng mạnh.
b) Chất tác dụng được với Na2CO3 sinh ra khí CO2 phải có tính acid mạnh hơn proton thứ nhất của \[{{\rm{H}}_{\rm{2}}}{\rm{C}}{{\rm{O}}_3}\] \[({{\rm{K}}_a} > 5 \times {10^{ - 7}}).\]
Lời giải chi tiết:
a) Hằng số phân li acid (KC) càng lớn, tính acid càng mạnh.
→ Thứ tự giảm dần tính acid của các hợp chất phenol: 2,4,6-trinitrophenol 2,4-dinitrophenol > 2-nitrophenol > 2-chlorophenol > phenol > 2-methylphenol.
b) Hằng số phân li của quá trình: \[{{\rm{H}}_{\rm{2}}}{\rm{C}}{{\rm{O}}_3} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{HCO}}_3^ - + {{\rm{H}}^ + }\] \[{{\rm{K}}_{\rm{a}}} = 5 \times {10^{ - 7}}\]
Chất phản ứng với Na2CO3 sinh ra khí CO2 phải có tính acid mạnh hơn proton thứ nhất của \[{{\rm{H}}_{\rm{2}}}{\rm{C}}{{\rm{O}}_3}\] \[({{\rm{K}}_a} > 5 \times {10^{ - 7}}).\]
Vậy chất phản ứng với Na2CO3 sinh ra khí CO2 là 2,4,6-trinitrophenol và 2,4-dinitrophenol.
17.16
Nhựa than đá hay hắc ín, là chất lỏng, sánh, sẫm màu; là sản phẩm phụ được tách ra trong quá trình luyện than cốc và khí than từ than đá. Hiện nay, có nhiều phương pháp để tách phenol ra khỏi nhựa than đá, dựa vào tính acid hoặc tính phân cực của phenol hoặc dựa vào nhiệt độ nóng chảy khác nhau giữa các hợp chất, ... Trong thành phần nhựa than đá có khoảng 33,67% phenol, 26,74% cresol (o, m, p-CH3C6H4-OH) về khối lượng và một số hợp chất có giá trị khác như xylenol, catechol, resocinol, ...
Dựa vào đặc điểm và tính chất của phenol (tính acid và phân cực), dùng sơ đồ biểu diễn sơ lược cách chiết tách các phenol từ nhựa than đá.
Phương pháp giải:
- Dựa vào tính acid của phenol: cho nhựa than đá phản ứng với dung dịch kiềm rồi dùng phương pháp chiết hoặc lọc để lấy tách dung dịch muối phenolate, sau đó acid hóa muối phenolate, thu được phenol.
- Dựa vào tính phân cực của phenol: dùng các dung môi phù hợp để tách lớp với thành phần còn lại, thu lấy dịch chiết, kết tinh, dùng máy li tâm để tách phenol
Lời giải chi tiết:
Dựa vào tính acid của phenol:
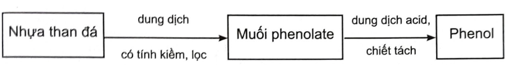
Nhựa than đá được trộn với dung dịch có tính kiềm (dung dịch kiềm, dung dịch amine, ...), phenol phản ứng tạo thành muối phenolate, tan trong dung dịch và tách lớp với các thành phần còn lại. Dùng phương pháp chiết hoặc lọc để lấy tách dung dịch muối phenolate, acid hoá bằng dung dịch acid (H+), thu được phenol.
Dựa vào tính phân cực của phenol:

Phenol tan trong một số dung môi (hỗn hợp dung môi) phù hợp, tách lớp với thành phần còn lại, thu lấy dịch chiết, kết tinh, dùng máy li tâm để tách phenol (các chất phenol, cresol, xylenol, catechol, resorcinol gọi chung là phenol).
17.17
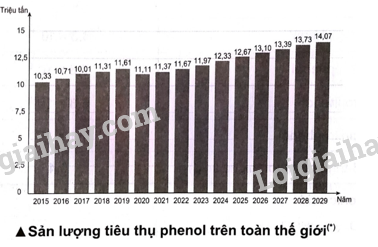
Thị trường tiêu thụ phenol trên toàn thế giới khoảng 11,37 triệu tấn trong năm 2021, dự kiến sẽ tăng lên 14,07 triệu tấn vào năm 2029. Phenol được sử dụng để sản xuất nhiều loại hoá chất như bisphenol A, nhựa phenolformaldehyde, picric acid và các chất khác. Khoảng 90% lượng phenol được sản xuất từ cumene (bằng phương pháp cumene, chu trình cumene, ...).
Để cung cấp đủ sản lượng tiêu thụ của phenol trong năm 2021, khối lượng cumene đã dùng để sản xuất phenol là bao nhiêu? (Chỉ tính trên lượng phenol đã tiêu thụ, không bao gồm lượng cumene thực tế sản xuất phenol chưa tiêu thụ).
Phương pháp giải:
Dựa vào kiến thức của phenol
Lời giải chi tiết:
Khối lượng phenol được sản xuất từ cumene vào năm 2021: \[11,37 \times \frac{{90\% }}{{100\% }} = 10,233\](triệu tấn).
Số mol của phenol (tính theo triệu tấn): \[{{\rm{n}}_{{\rm{phenol}}}} = \frac{{10,233}}{{94}}{\rm{ }}({\rm{mol}})\]
Phương trình hóa học:
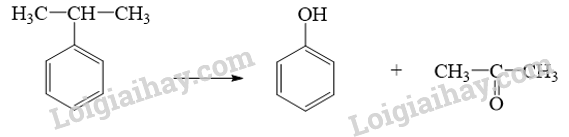
Ta có: \[{{\rm{n}}_{{\rm{cumene}}}} = {{\rm{n}}_{{\rm{phenol}}}} = \frac{{10,233}}{{94}}{\rm{ }}({\rm{mol}})\]
\[ \Rightarrow {{\rm{m}}_{{\rm{cumene}}}} = \frac{{10,233}}{{94}}{\rm{ }} \times {\rm{120 }} \approx {\rm{13,06 }}\](triệu tấn)
Luyện Bài Tập Trắc nghiệm Hóa 11 - Chân trời sáng tạo - Xem ngay
Các bài khác cùng chuyên mục
- Bài 16. Alcohol trang 75, 76 77, 78, 79, 80, 81 SBT Hoá 11 Chân trời sáng tạo
- Bài Ôn tập chương 6 trang 102, 103, 104, 105, 106 SBT Hóa 11 Chân trời sáng tạo
- Bài 19. Carboxylic acid trang 96, 97, 98, 99, 100, 101 SBT Hóa 11 Chân trời sáng tạo
- Bài 18. Hợp chất carbonyl (aldehyde – ketone) trang 91, 92, 93, 94 SBT Hóa 11 Chân trời sáng tạo
- Bài Ôn tập chương 5 trang 87, 88, 89, 90 SBT Hóa 11 Chân trời sáng tạo
- Bài Ôn tập chương 6 trang 102, 103, 104, 105, 106 SBT Hóa 11 Chân trời sáng tạo
- Bài 19. Carboxylic acid trang 96, 97, 98, 99, 100, 101 SBT Hóa 11 Chân trời sáng tạo
- Bài 18. Hợp chất carbonyl (aldehyde – ketone) trang 91, 92, 93, 94 SBT Hóa 11 Chân trời sáng tạo
- Bài Ôn tập chương 5 trang 87, 88, 89, 90 SBT Hóa 11 Chân trời sáng tạo
- Bài 15. Dẫn xuất halogen trang 70, 71, 72, 73, 74 SBT Hóa 11 Chân trời sáng tạo





 không phải là alcohol.
không phải là alcohol.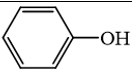 không phải là alcohol.
không phải là alcohol.







Danh sách bình luận