 Giải chuyên đề học tập Hóa 12 Kết nối tri thức với cuộc sống
Giải chuyên đề học tập Hóa 12 Kết nối tri thức với cuộc sống
 Chuyên đề 3: Một số vấn đề cơ bản về phức chất
Chuyên đề 3: Một số vấn đề cơ bản về phức chất Bài 8. Liên kết và cấu tạo của phức chất - Chuyên đề học tập Hóa 12 Kết nối tri thức
Trong phức chất [MLn],
CH tr 40
Trong phức chất [MLn], các phối tử L sắp xếp xung quanh nguyên tử trung tâm M tạo ra các dạng hình học khác nhau. Vậy, sự hình thành liên kết trong phức chất tứ diện và phức chất bát diện được giải thích như thế nào theo thuyết liên kết hoá trị?
Phương pháp giải:
Dựa vào liên kết trong phức chất.
Lời giải chi tiết:
Theo thuyết liên kết hoá trị, liên kết trong phức chất có dạng hình học tứ diện được hình thành từ sự cho cặp electron chưa liên kết của phối tử vào các orbital lai hoá sp3 trống của nguyên tử trung tâm.
Theo thuyết liên kết hoá trị, liên kết trong phức chất có dạng hình học bát diện ( còn được gọi là phức chất bát diện) được hình thành từ sự cho cặp electron chưa liên kết của phối tử đến các orbital lai hoá d2sp3 hoặc sp3d2 trống của nguyên tử trung tâm.
CH tr 41 CH1
Xác định nguyên tử trung tâm và kiểu lai hoá của nó trong phức chất [Zn(NH3)4]2+ có dạng hình học tứ diện và phức chất [CoF6]3-.
Phương pháp giải:
Dựa vào liên kết trong phức chất.
Lời giải chi tiết:
Phức chất [Zn(NH3)4]2+
+ Nguyên tử trung tâm: Zn2+
+ Kiểu lai hóa : sp3
Phức chất [CoF6]3-.
+ Nguyên tử trung tâm: Co3+
+ Kiểu lai hóa : sp3d2
CH tr 41 CH2
Phức chất [CoCl2(en)2]+ có cấu tạo như sau:
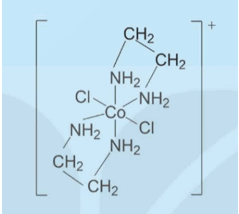
a) Chỉ ra các phối tử trong phức chất trên và dung lượng phối trí của chúng.
b) Chỉ ra nguyên tử trung tâm trong phức chất trên và số phối trí của nó.
c) Nguyên tử trung tâm trong phức chất trên đã nhận cặp electron từ nguyên tử nào của các phối tử?
d) Nêu dạng hình học của phức chất trên.
Phương pháp giải:
Dựa vào liên kết trong phức chất.
Lời giải chi tiết:
a) Phối tử Cl, dung lượng phối trí là 1.
Phối tử ethylenediamine, dung lượng phối trí là 2.
b) Nguyên tử trung tâm trong phức chất: Co, số phối trí là 6.
c) Nguyên tử trung tâm trong phức chất trên nhận cặp electron từ nguyên tử N và Cl của phối tử.
d) Dạng hình học của phức chất là: bát diện.
CH tr 42
Biết phức chất [NiCl4]2- có dạng hình học tứ diện.
a) Xác định nguyên tử trung tâm và số phối trí của nguyên tử trung tâm.
b) Trình bày sự hình thành liên kết trong phức chất [NiCl4]2- theo thuyết liên kết hoá trị, biết Ni có Z=28.
Phương pháp giải:
Dựa vào sự hình thành liên kết trong phức chất tứ diện
Lời giải chi tiết:
Nguyên tử trung tâm: Ni2+, số phối trí của nguyên tử trung tâm: 4
Nguyên tử trung tâm là Ni2+ có cấu hình [Ar]3d8. Để tạo ra dạng hình học tứ diện thì nguyên tử trung tâm Ni2+ lai hoá sp3, bốn phối tử Cl cho cặp electron chưa liên kết của nguyên tử Cl vào bốn orbital lai hoá sp3 trống của Ni2+, tạo thành bốn liên kết.
CH tr 43 CH1
Dự đoán dạng hình học của phức chất [Ti(H2O)6]3+ và kiểu lai hoá của nguyên tử trung tâm trong phức chất, biết Ti có Z=22.
Phương pháp giải:
Dựa vào sự hình thành liên kết trong phức chất bát diện.
Lời giải chi tiết:
Nguyên tử trung tâm Ti3+ có cấu hình electron: [Ar]3d1
Dự đoán hình học: hình học bát diện
Kiểu lai hoá: d2sp3
CH tr 43 CH2
Mô tả sự hình thành phức chất [FeF6]3- theo thuyết liên kết hoá trị. Biết Fe có Z=26.
Phương pháp giải:
Dựa vào sự hình thành liên kết trong phức chất bát diện.
Lời giải chi tiết:
Ion trung tâm của phức chất là: Fe3+
Cấu hình electron của Fe3+: [Ar]3d5
Để tạo ra dạng hình học bát diện, nguyên tử trung tâm Fe3+ lai hoá sp3d2 , 6 phối tử F- cho cặp electron chưa liên kết vào 6 orbital lai hoá sp3d2 trống của Fe3+ tạo thành 6 liên kết.
CH tr 43 HĐ
Biểu diễn dạng hình học của phức chất tứ diện [NiCl4]2- và phức chất bát diện [Fe(H2O)6]3+.
Phương pháp giải:
Dựa vào một số đồng phân cơ bản của phức chất.
Lời giải chi tiết:
|
Dạng hình học của phức chất tứ diện [NiCl4]2- |
Dạng hình học của phức chất bát diện [Fe(H2O)6]3+.
|
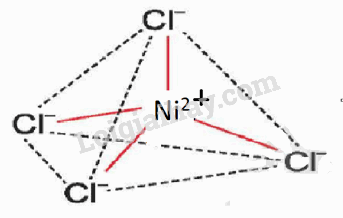 |
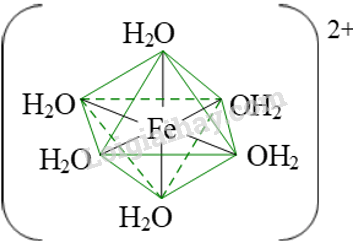 |
CH tr 44
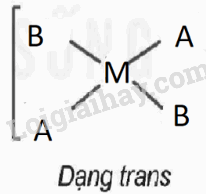
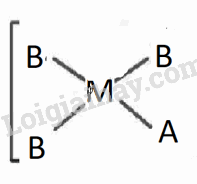
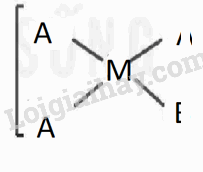
Xét phức chất vuông phẳng có nguyên tử trung tâm M và hai loại phối tử A,B. Cả A và B đều có dung lượng phối trí là 1.
1. Viết các công thức hoá học có thể có của phức chất (bỏ qua điện tích của phức chất).
2. Biểu diễn dạng hình học có thể có của các phức chất.
Phương pháp giải:
Dựa vào một số đồng phân cơ bản của phức chất.
Lời giải chi tiết:
1. CTHH: MA2B2, MAB3,MA3B
2. Biểu diễn dạng hình học
|
MA2B2 |
MAB3
|
,MA3B
|
|
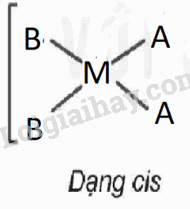 |
 |
 |
 |
CH tr 45 CH1
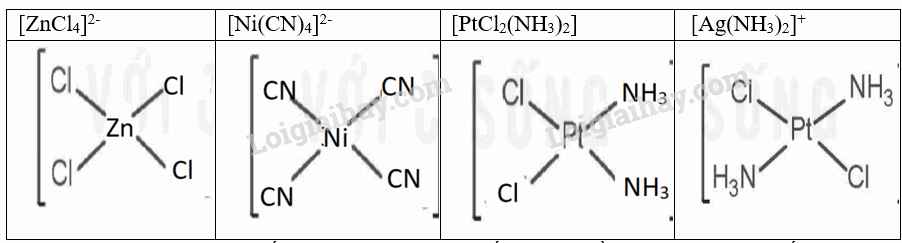
Cho các phức chất sau: [Ag(NH3)2]+, [ZnCl4]2-, [Ni(CN)4]2-, [PtCl2(NH3)2] ( vuông phẳng).
a) Phức chất nào có đồng phân cis-, trans-?
b) Vẽ đồng phân cis-, trans- ( nếu có) của mỗi phức chất.
Phương pháp giải:
Dựa vào một số đồng phân cơ bản của phức chất.
Lời giải chi tiết:
a) Phức chất có đồng phân cis là: [ZnCl4]2-, [Ni(CN)4]2-, [PtCl2(NH3)2]
b) Phức chất có đồng phân trans là: [Ag(NH3)2]+
CH tr 45 CH2
Cho phức chất: [Ni(NH3)6]2+ và [PdCl2(NH3)4].
a) Phức chất nào có đồng phân cis-, trans-?
b) Vẽ đồng phân cis-, trans- (nếu có) của mỗi phức chất.
Phương pháp giải:
Dựa vào một số đồng phân cơ bản của phức chất.
Lời giải chi tiết:
a) Phức chất có đồng phân cis: : [Ni(NH3)6]2+ và [PdCl2(NH3)4].
Phức chất có đồng phân trans: [PdCl2(NH3)4].
|
b) Hình học của phức chất có đồng phân cis: : [Ni(NH3)6]2+ |
Hình học của phức chất có đồng phân cis, trans: [PdCl2(NH3)4]. |
|
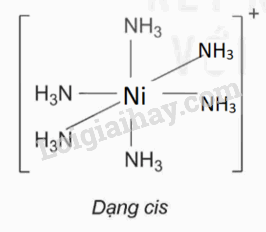 |
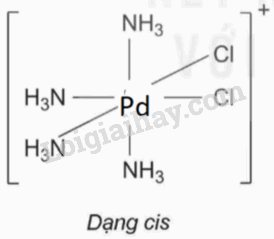 |
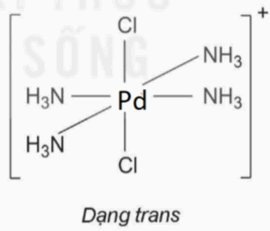 |
CH tr 46
Phức chất (A) và phức chất (B) có cấu tạo như sau:
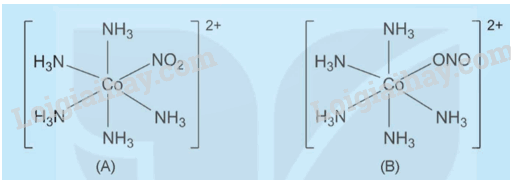
Hãy chỉ ra sự khác nhau về cấu tạo của hai phức chất này.
Phương pháp giải:
Dựa vào đồng phân liên kết.
Lời giải chi tiết:
Hình A: phối tử NO2- liên kết với Co qua nguyên tử N
Hình B: phối tử NO2- liên kết với Co qua nguyên tử O
Luyện Bài Tập Trắc nghiệm Hóa 12 - Kết nối tri thức - Xem ngay
Các bài khác cùng chuyên mục
- Bài 9. Vai trò và ứng dụng của phức chất - Chuyên đề học tập Hóa 12 Kết nối tri thức
- Bài 8. Liên kết và cấu tạo của phức chất - Chuyên đề học tập Hóa 12 Kết nối tri thức
- Bài 7. Một số vấn đề cơ bản về phức chất - Chuyên đề học tập Hóa 12 Kết nối tri thức
- Bài 6. Xử lí nước sinh hoạt - Chuyên đề học tập Hóa 12 Kết nối tri thức
- Bài 5. Công nghiệp silicate - Chuyên đề học tập Hóa 12 Kết nối tri thức
- Bài 9. Vai trò và ứng dụng của phức chất - Chuyên đề học tập Hóa 12 Kết nối tri thức
- Bài 8. Liên kết và cấu tạo của phức chất - Chuyên đề học tập Hóa 12 Kết nối tri thức
- Bài 7. Một số vấn đề cơ bản về phức chất - Chuyên đề học tập Hóa 12 Kết nối tri thức
- Bài 6. Xử lí nước sinh hoạt - Chuyên đề học tập Hóa 12 Kết nối tri thức
- Bài 5. Công nghiệp silicate - Chuyên đề học tập Hóa 12 Kết nối tri thức












Danh sách bình luận