Câu hỏi
Cho 7,36 gam hỗn hợp X gồm Mg và Fe vào dung dịch chứa AgNO3 và Cu(NO3)2 khi phản ứng kết thúc thu được chất rắn Y và dung dịch Z. Hòa tan hết Y bằng dung dịch H2SO4 đặc nóng dư thu được 5,04 lít khí SO2 đktc (là sản phẩm khử duy nhất). Cho dung dịch NaOH dư vào Z được kết tủa T. Nung T trong không khí đến khối lượng không đổi được 7,2 gam hỗn hợp rắn. Phần trăm khối lượng của Fe trong X là:
- A 38,04%
- B 83,7%
- C 60,87%
- D 49,46%
Phương pháp giải:
Lập sơ đồ cả quá trình diễn biến phản ứng trong đề bài, từ đó biện luận chất rắn cuối cùng gồm thành phần gì, chất nào dư sau phản ứng => thành phần các chất trong các hỗn hợp.
Áp dụng định luật bảo toàn electron, bảo toàn nguyên tố để tìm số mol các chất trong X
=> %mFe(X)
Lời giải chi tiết:
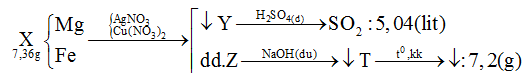
- Giả sử Mg, Fe đều phản ứng hết với muối kim loại => Z chứa toàn bộ số mol Mg2+ ; Fex+
=> T chứa Mg(OH)2 và Fe(OH)x => Chất rắn cuối cùng là MgO và Fe2O3 chắc chắn phải có khối lượng lớn hơn lượng kim loại ban đầu trong X => Không thỏa mãn đề bài (7,2 < 7,36)
=> Các muối nitrat phản ứng hết, kim loại dư và đó là Fe (vì Mg phản ứng trước)
=> kết tủa Y gồm Cu, Ag, Fe.
- Gọi nMg = a ; nFe(pứ) = b ; nFe dư = c => mX = 24a + 56b + 56c = 7,36 (1)
- Bảo toàn e cho phản ứng trao đổi muối : 2nMg + 2nFe pứ = nAg + 2nCu = 2a + 2b
- Khi Y + H2SO4 đặc nóng (Fe → Fe3+)
Bảo toàn electron : 2nCu + nAg + 3nFe dư = 2nSO2 = 2.5,04/22,4 = 0,45 mol
=> 2a + 2b + 3c = 0,45 (2)
- Như đã phân tích ở trên. chất rắn cuối cùng gồm MgO và Fe2O3.
Bảo toàn nguyên tố : nMg = nMgO = a ; nFe2O3 = ½ nFe pứ = 0,5b
=> mrắn = mMgO + mFe2O3 = 40a + 160.0,5b = 40a + 80b = 7,2 (3)
Từ (1,2,3) => a = 0,12 ; b = 0,03 ; c = 0,05 mol
=> mFe(X) = 56.(0,03 + 0,05) = 4,48g
=> %mFe(X) = 4,48 : 7,36 = 60,87%
Đáp án C







