Câu hỏi
Cho m gam hỗn hợp X gồm Fe, Fe3O4 và Fe(NO3)2 tan hết trong 320 ml dung dịch KHSO4 1M. Sau phản ứng, thu được dung dịch Y chứa 59,04 gam muối trung hòa và 896 ml NO (sản phẩm khử duy nhất của N+5, ở đktc). Y phản ứng vừa đủ với 0,44 mol NaOH. Biết các phản ứng xảy ra hoàn toàn. Phần trăm khối lượng của Fe(NO3)2 trong X có giá trị gần nhất với giá trị nào sau đây?
- A 63%
- B 18%
- C 20%
- D 73%
Phương pháp giải:
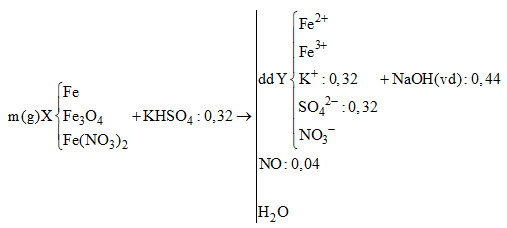
Áp dụng các định luật bảo toàn nguyên tố, bảo toàn khối lượng, bảo toàn điện tích để tính số mol của các thành phần trong sơ đồ.
Lời giải chi tiết:

BTNT “H”: nH2O = nKHSO4 : 2 = 0,18 mol
BTKL: m = m muối trong Y + mNO + mH2O – mKHSO4 = 59,04 + 0,04.30 + 0,18.18 – 0,32.136 = 19,96 gam
nNaOH = 2nFe2+ + 3nFe3+ = 0,44 mol
BTĐT: 2nFe2+ + 3nFe3+ + nK+ = 2nSO42- + nNO3- => 0,44 + 0,32 = 2.0,32 + nNO3-
=> nNO3- = 0,12 mol
BTNT “N”: nFe(NO3)2 = (nNO3- + nNO)/2 = (0,12 + 0,04)/2 = 0,08 mol
=> %mFe(NO3)2 = (0,08.180)/19,96 = 72,14% gần nhất với 73%
Đáp án D







