Câu hỏi
Hoà tan hoàn toàn 12,42 gam Al bằng dung dịch HNO3 loãng (dư), thu được dung dịch X và 1,344 lít (ở đktc) hỗn hợp khí Y gồm hai khí là N2O và N2. Tỉ khối của hỗn hợp khí Y so với khí H2 là 18. Cô cạn dung dịch X, thu được m gam chất rắn khan. Giá trị của m là:
- A 38,34 gam
- B 34,08 gam
- C 106,38 gam
- D 97,98 gam
Phương pháp giải:
Phương pháp:
nAl = 0,46 mol → ne cho =0,46.3= 1,38 mol
nY = 0,06 mol ; = 36
Áp dụng phương pháp đường chéo =>
→ ne nhân = = 8.0,03+10.0,03 = 0,54 mol < ne cho
→ dung dịch X còn chứa muối NH4NO3
=>
=> mX =
Lời giải chi tiết:
Hướng dẫn giải
nAl = 0,46 mol → ne cho =0,46.3= 1,38 mol
nY = 0,06 mol ; 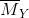 = 36
= 36
N2O 44 8
36
N2 28 8
=> 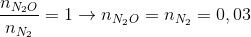
→ ne nhân = 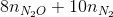 = 8.0,03+10.0,03 = 0,54 mol < ne cho
= 8.0,03+10.0,03 = 0,54 mol < ne cho
→ dung dịch X còn chứa muối NH4NO3
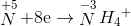
ne nhận =n e cho = 1,38
=> 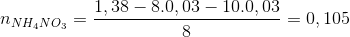
=> mX = 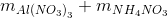 = 0,46.213 + 0,105.80 = 106,38 gam
= 0,46.213 + 0,105.80 = 106,38 gam
Đáp án C.







