Câu hỏi
Hòa tan hoàn toàn m gam Al bằng dung dịch HNO3 loãng, thu được 5,376 lít(đktc) hỗn hợp khí X gồm N2, N2O và dung dịch chứa 8m gam muối. Tỉ khối của X so với H2 bằng 18. Giá trị của m là:
- A 29,16 gam.
- B 21,6 gam.
- C 18,9 gam.
- D 17,28 gam.
Phương pháp giải:
Tìm số mol từng khí N2; N2O dựa vào quy tắc đường chéo
Giả sử trong dung dịch thu được chứa muối NH4NO3
Đặt mol Al = a (mol) ; nNH4NO3 = b (mol)
Ta có hệ phương trình sau:
\(\begin{array}{l}\left\{ \begin{array}{l}BT:e \to 3{n_{Al}} = 10{n_{{N_2}}} + 8{n_{{N_2}O}} + 8{n_{N{H_4}N{O_3}}}\\\frac{{{m_{Al}}}}{{{m_{Al(NO3)3}} + {m_{N{H_4}N{O_3}}}}} = \frac{m}{{8m}} = \frac{1}{8}\end{array} \right.\\ \Rightarrow \left\{ \begin{array}{l}3a - 8b = 2,16\\3a - 80b = 0\end{array} \right. \Rightarrow \left\{ \begin{array}{l}a = ?\\b = ?\end{array} \right.\end{array}\)
=> m = mAl = 27a = ? (g)
Lời giải chi tiết:
nhh X = 5,376 :22,4 = 0,24 (mol)
MX = 18.2 = 36 (g/mol)
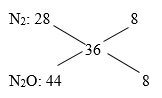
\( \Rightarrow \frac{{{n_{{N_2}}}}}{{{n_{{N_2}O}}}} = \frac{8}{8} = \frac{1}{1} = \frac{{0,12}}{{0,12}}\)
Gọi nAl = a (mol)
Giả sử trong dd có chứa muối NH4NO3: b (mol)
\(\begin{array}{l}\left\{ \begin{array}{l}BT:e \to 3{n_{Al}} = 10{n_{{N_2}}} + 8{n_{{N_2}O}} + 8{n_{N{H_4}N{O_3}}}\\\frac{{{m_{Al}}}}{{{m_{Al(NO3)3}} + {m_{N{H_4}N{O_3}}}}} = \frac{m}{{8m}} = \frac{1}{8}\end{array} \right.\\ \Rightarrow \left\{ \begin{array}{l}3a = 10.0,12 + 8.0,12 + 8b\\\frac{{27a}}{{213a + 80b}} = \frac{1}{8}\end{array} \right. \Rightarrow \left\{ \begin{array}{l}3a - 8b = 2,16\\3a - 80b = 0\end{array} \right. \Rightarrow \left\{ \begin{array}{l}a = 0,8\\b = 0,03\end{array} \right.\end{array}\)
nAl = 0,8 (mol) => mAl = 0,8.27 = 21,6 (g)
Vậy giá trị của m = 21,6 gam
Đáp án B







