Câu hỏi
Cho 36 gam hỗn hợp Fe, FeO, Fe3O4 tác dụng hoàn toàn với dung dịch H2SO4 đặc, nóng dư thấy thoát ra 5,6 lít khí SO2 ở đktc (sản phẩm khử duy nhất). Tính số mol của H2SO4 đã phản ứng.
- A 0,5 mol
- B 1 mol
- C 1,5 mol
- D 0,75 mol
Phương pháp giải:
Đối với các bài toàn liên quan đến hỗn hợp của sắt và oxit sắt ta thường quy đổi hỗn hợp thành sắt và oxi để chuyển nhiều ẩn là số mol của các oxit sắt và sắt trở thành 2 ẩn là số mol của sắt và oxi
Sau đó sự dụng các phương pháp bảo toàn như bảo toàn e, bảo toàn nguyên tố, bảo toàn khối lượng để tính theo yêu cầu đề bài
Lời giải chi tiết:
Quy đổi hỗn hợp \(Fe,FeO,F{e_3}{O_4}\)thành hỗn hợp gồm Fe : x mol và O: y mol
\( \Rightarrow 56x + 16y = 36\) (1)
\({n_{S{O_2}}} = 0,25(mol)\)
Sơ đồ phản ứng:
\(\left\{ \matrix{ Fe:x(mol) \hfill \cr O:y(mol) \hfill \cr} \right.\buildrel {{H_2}S{O_4}} \over \longrightarrow \left\{ \matrix{ F{e_2}{(S{O_4})_3} \hfill \cr S{O_2} \hfill \cr {H_2}O \hfill \cr} \right.\)
Các quá trình cho – nhận e:
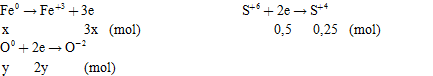
Áp dụng định luật bảo toàn e
\(\Rightarrow 3x = 0,5 + 2y\)(2)
Từ (1) và (2) ta có hệ phương trình
\(\left\{ \matrix{ 56x + 16y = 36 \hfill \cr 3x = 0,5 + 2y \hfill \cr} \right. \Leftrightarrow \left\{ \matrix{ x = 0,5(mol) \hfill \cr y = 0,5(mol) \hfill \cr} \right.\)
Áp dụng định luật bảo toàn nguyên tố Fe ta có:
\({n_{F{e_2}{{(S{O_4})}_3}}} = {1 \over 2}{n_{Fe}}\)
\(\Rightarrow {n_{S(trong}}_{F{e_2}{{(S{O_4})}_3})} = {3 \over 2}{n_{Fe}}\)
Áp dụng định luật bảo toàn nguyên tố S ta có
\(\eqalign{ & {n_{{H_2}S{O_4}}} = {n_{S(trong}}_{F{e_2}{{(S{O_4})}_3})} + {n_{S(S{O_2})}} \cr & \Leftrightarrow {n_{{H_2}S{O_4}}} = {3 \over 2}{n_{Fe}} + {n_{S{O_2}}} = {3 \over 2} \cdot 0,5 + 0,25 = 1(mol) \cr} \)
Đáp án B







