Câu hỏi
Khi nhỏ từ từ đến dư dung dịch HCl vào dung dịch hỗn hợp gồm a mol NaOH và b mol Ba(AlO2)2, kết quả thí nghiệm được biểu diễn bằng đồ thị sau:
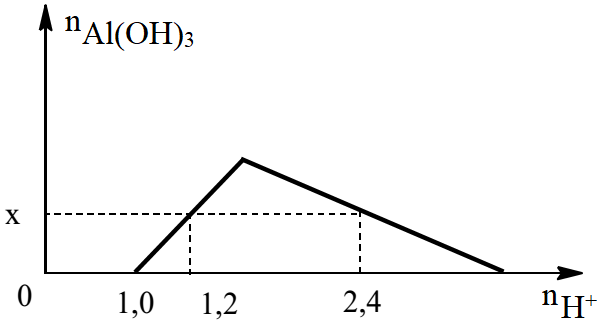
Tỉ lệ a : b là
- A 3 : 1.
- B 2 : 1.
- C 2 : 3.
- D 4 : 1.
Phương pháp giải:
Bài toán cho từ từ H+ vào {OH-, AlO2-}
Thứ tự phản ứng khi cho từ từ H+ vào OH-; AlO2- là:
(1) H+ + OH- → H2O
(2) H+ + AlO2- + H2O → Al(OH)3
(3) 3H+ + Al(OH)3 → Al3+ + 3H2O
Như vậy, khi cho từ từ H+ vào OH-; AlO2- thì:
- Đầu tiên, H+ trung hòa OH- nên chưa thấy xuất hiện kết tủa, khi đó chỉ xảy ra (1)
→ nH+ (1) = nOH-
- Khi H+ bị trung hòa hết, kết tủa sẽ tăng từ từ cho đến khi cực đại khi đó xảy ra (2)
→ nH+ (2) = nAlO2-
- Khi H+ dư thì kết tủa sẽ bị tan dần cho đến hết khi đó xảy ra (3)
→ nH+(3) = 3nAl(OH)3 bị tan = 3.(nAlO2- - nAl(OH)3)
Vậy ta có công thức tính nhanh trường hợp kết tủa tan:
∑nH+ = nOH- + nAlO2- + 3.(nAlO2- - nAl(OH)3) = nOH- + 4nAlO2- - 3nAl(OH)3
Lời giải chi tiết:
Khi cho từ từ dung dịch HCl vào thì HCl phản ứng với NaOH trước, sau đó HCl mới phản ứng với Ba(AlO2)2 tạo thành kết tủa.
(1) H+ + OH- → H2O
(2) H+ + AlO2- + H2O → Al(OH)3
(3) 3H+ + Al(OH)3 → Al3+ + 3H2O
- Khi nH+ = 1,0 mol thì (1) vừa kết thúc, suy ra a = nOH- = nH+ = 1,0 (mol)
- Khi nH+ = 1,2 mol thì (1) đã kết thúc và đang xảy ra (2) (lúc này kết tủa chưa bị hòa tan)
Suy ra \({n_{{H^ + }}} = {n_{O{H^ - }}} + {n_{Al{{(OH)}_3}}} = 1,2(mol)\) → nAl(OH)3 = 1,2 - 1,0 = 0,2 (mol)
- Khi nH+ = 2,4 mol thì xảy ra cả phản ứng (1), (2) đã kết thúc và đang xảy ra (3) (kết tủa bị hòa tan 1 phần)
Ta có: nH+ = nOH- + 4.nAlO2- - 3.nAl(OH)3 → 2,4 = 1 + 4.nAlO2- - 3. 0,2 → nAlO2- = 0,5 mol
→ b = nBa(AlO2)2 = 0,25 mol
Vậy tỉ lệ a : b = 1 : 0,25 = 4 : 1
Đáp án D







