Câu hỏi
Điện phân 800 ml dung dịch gồm NaCl, HCl và CuCl2 0,02M (điện cực trơ, màng ngăn xốp) với cường độ dòng điện 9,65A. Mối liên hệ giữa thời gian điện phân và pH của dung dịch điện phân được biểu diễn bằng đồ thị dưới đây (giả sử muối đồng không bị thủy phân):
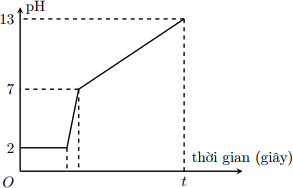
Giá trị của t trên đồ thị là
- A 2400.
- B 3600.
- C 1200.
- D 3800
Phương pháp giải:
*Đoạn 1: pH không thay đổi trong khoảng thời gian catot khử Cu2+ và anot oxi hóa ion Cl-.
Catot: Cu2+ + 2e → Cu
→ ne đoạn 1 = 2.nCu2+
*Đoạn 2: pH tăng nhanh chóng do H+ bị khử cho tới khi hết tại catot:
Catot: 2H+ + 2e → H2
→ ne đoạn 2 = nH+
*Đoạn 3: pH tiếp tục tăng, dung dịch chuyển sang môi trường kiềm do H2O bị khử tại catot tạo OH-.
Catot: 2H2O + 2e → 2OH- + H2
→ ne đoạn 3 = nOH-
Vậy số mol electron trao đổi trong cả 3 giai đoạn bằng
ne trao đổi = ne đoạn1 + ne đoạn2 + ne đoạn3
Mặt khác ta có: ne trao đổi = It/F. Từ đó tính được giá trị t.
Lời giải chi tiết:
Ta có: nCuCl2 = 0,8.0,02 = 0,016 (mol)
Ban đầu: pH = 2 → [H+] = 10-2 (M) = 0,01 M → nHCl = 0,01.0,8 = 0,008 mol
*Đoạn 1: pH không thay đổi trong khoảng thời gian catot khử Cu2+ và anot oxi hóa ion Cl-.
Catot: Cu2+ + 2e → Cu
→ ne đoạn 1 = 2.nCu2+ = 2.0,016 = 0,032 (mol)
*Đoạn 2: pH tăng nhanh chóng do H+ bị khử cho tới khi hết tại catot:
Catot: 2H+ + 2e → H2
→ ne đoạn 2 = nH+ = 0,008 mol
*Đoạn 3: pH tiếp tục tăng, dung dịch chuyển sang môi trường kiềm do H2O bị khử tại catot tạo OH-.
Ta có: pH = 13 → [H+] = 10-13M → [OH-] = 0,1 M → nOH- = 0,8.0,1 = 0,08 mol
Catot: 2H2O + 2e → 2OH- + H2
Ta có: ne đoạn3 = nOH- = 0,08 mol
Vậy số mol electron trao đổi trong cả 3 giai đoạn bằng
ne trao đổi = ne đoạn1 + ne đoạn2 + ne đoạn3 = 0,032 + 0,008 + 0,08 = 0,12 (mol)
Mặt khác ta có: ne trao đổi = It/F → t = 0,12.96500/9,65 = 1200 (s)
Đáp án C







