Câu hỏi
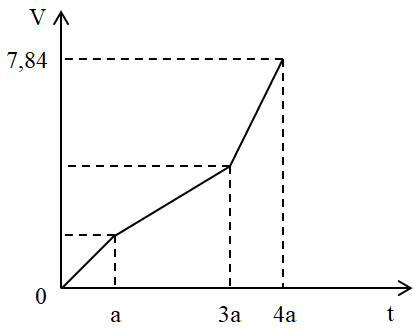
Điện phân dung dịch X chứa Cu(NO3)2 và NaCl với điện cực trơ. Tổng thể tích khí thoát ra ở cả 2 điện cực (V lít) phụ thuộc vào thời gian điện phân (t giây) theo đồ thị bên. Nếu điện phân X trong thời gian 3,5a giây thì thu được dung dịch có khối lượng giảm m gam so với dung dịch X. Giả thiết các chất điện phân ra không tan trong dung dịch. Giá trị của m là:
- A 31,1
- B 29,5
- C 31,3
- D 30,4
Phương pháp giải:
Đoạn 1: Chỉ có khí Cl2 thoát ra. Đặt VCl2 = x (lít)
Đoạn 2: Chỉ có khí O2 thoát ra: VO2 = x (lít)
Đoạn 3: Anot có O2 tiếp tục thoát ra. Còn ở catot có H2 thoát ra.
Bảo toàn e để tìm giá trị x. Từ đó tính được số mol NaCl và số mol Cu(NO3)2 ban đầu.
Dùng bảo toàn electron tại thời điểm 3,5a giây để tính số mol Cu, H2 và Cl2, O2 thoát ra.
Khối lượng dung dịch giảm chính là khối lượng các chất thoát ra ở các điện cực.
Lời giải chi tiết:
Đoạn 1: Chỉ có khí Cl2 thoát ra.
Đặt VCl2 = x (lít)
Đoạn 2: Chỉ có khí O2 thoát ra.
Mà ta thấy giá trị V lúc này gấp đôi đoạn tại thời điểm t = a (giây)
Do đó VO2 = 2x - x = x (lít)
Đoạn 3: Anot có O2 tiếp tục thoát ra. Còn ở catot có H2 thoát ra.
Trong đoạn 3 này thời gian bằng nửa đoạn 2 nên VO2 = 0,5x (lít)
Bảo toàn electron ta tính được VH2 = x (lít)
Tổng cộng 3 đoạn thì khí thoát ra gồm Cl2 (x lít), O2 (1,5x lít) và H2 (x lít)
Suy ra x + 1,5x + x = 7,84 → x = 2,24 lít
Ban đầu: nNaCl =2.nCl2 = 0,2 mol
Ta có: nCu(NO3)2 = nCu = nCl2 + 2.nO2 (đoạn 2) = 0,3 mol
Tại thời điểm t = a (giây): ne trao đổi = 2nCl2 = 2.2,24 : 22,4 = 0,2 mol
Tại thời điểm 3,5a (giây) (thuộc đoạn 3) ta có: ne trao đổi = 3,5. 0,2 = 0,7 mol
Catot:
Cu2+ + 2e → Cu
0,3 → 0,6 0,3 mol
H2O + 2e → H2 + 2OH-
0,1 → 0,05 mol
Anot:
2Cl- -2e → Cl2
0,2 0,2 0,1 mol
2H2O - 4e → O2 + 4H+
0,5 0,125 mol
Khi đó thu được 0,3 mol Cu ; 0,05 mol H2 ở catot và 0,1 mol Cl2 và 0,125 mol O2 ở anot.
Khối lượng dung dịch giảm chính là khối lượng các chất thoát ra ở các điện cực.
Do đó m = mCu + mH2 + mCl2 + mO2 = 0,3.64 + 0,05.2 + 0,1.71 + 0,125.32 = 30,4 (gam)
Đáp án D







