Câu hỏi
Cho 2,13 gam P2O5 vào dung dịch có chứa 1,6 gam NaOH, thêm nước vào cho vừa đủ 400 ml. Tính CM của các muối trong dung dịch thu được?
- A 0,01 và 0,02
- B 0,025 và 0,05
- C 0,0375 và 0,0375
- D 0,015 và 0,015
Phương pháp giải:
Các phản ứng xảy ra:
P2O5 + 3H2O → 2H3PO4
H3PO4 + OH- → H2PO4- + H2O
H3PO4 + 2OH- → HPO42- + 2H2O
H3PO4 + 3OH- → PO43- + 3H2O
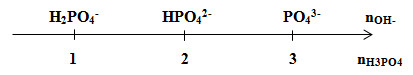
Giải thích trục số:
Đặt \((*) = \frac{{{n_{O{H^ - }}}}}{{{n_{{H_3}P{O_4}}}}}\)
+ Nếu (*) < 1 → H3PO4 dư và H2PO4-
+ Nếu (*) = 1 → H2PO4-
+ Nếu 1 < (*) < 2 → H2PO4- và HPO42-
+ Nếu (*) = 2 → HPO42-
+ Nếu 2 < (*) < 3 → HPO42- và PO43-
+ Nếu (*) = 3 → PO43-
+ Nếu (*) > 3 → PO43- và OH‑ dư
Dựa vào tỉ lệ (*) để xác định sản phẩm thu được. Từ đó tính toán theo phương trình tìm được số mol chất tan thu được sau phản ứng và CM của các muối trong dung dịch.
Lời giải chi tiết:
Ta có: nP2O5 = 0,015 mol suy ra nH3PO4 = 0,03 mol; nNaOH = 0,04 mol
Xét tỉ lệ 1 < nOH- : nH3PO4 = 4 : 3 = 1,33 < 2 → Tạo muối H2PO4- và HPO42-.
Đặt nH2PO4- = x mol và nHPO4(2-) = y mol
Ta có: x + y = 0,03 mol và nNaOH = x + 2y = 0,04 mol
Giải hệ trên ta có x = 0,02 và y = 0,01
Vậy CM (NaH2PO4) = 0,02/0,4 = 0,05M và CM (NaHPO4) = 0,01/0,4 = 0,025M
Đáp án B







