Câu hỏi
Cho m gam hỗn hợp bột Mg và Cu tác dụng với 100 ml dung dịch chứa hỗn hợp hai muối AgNO3 0,5M và Cu(NO3)2 0,75M. Sau khi phản ứng xong, được dung dịch A và chất rắn B. Cho A tác dụng với dung dịch NaOH dư, lọc lấy kết tủa đem nung đến khối lượng không đổi được 5,6 gam hỗn hợp hai oxit. Hòa tan hoàn toàn B trong H2SO4 đặc, nóng được 1,792 lít khí SO2 (đktc). Giá trị của m là
- A 2,72.
- B 2,96.
- C 5,04.
- D 4,69.
Phương pháp giải:
- Do cho A tác dụng với NaOH dư, lọc kết tủa đem nung thu được 2 oxit nên dd A có chứa Mg(NO3)2 và Cu(NO3)2 (không còn AgNO3)
- Do dd A chứa Cu(NO3)2 nên Mg hết → Chất rắn B chứa Cu, Ag
Sơ đồ tóm tắt:
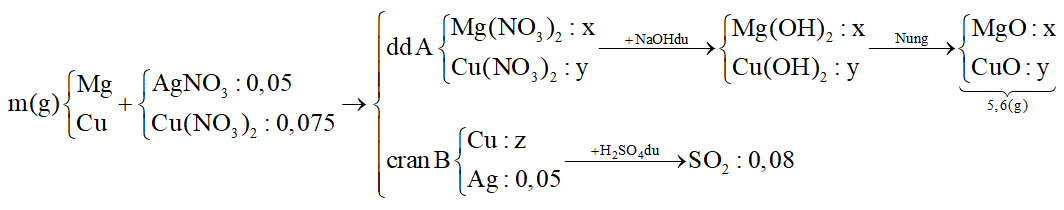
- Khi cho B tác dụng với H2SO4 đặc nóng:
Áp dụng bảo toàn e → nCu(chất rắn B)
- Khi cho A tác dụng với NaOH dư lọc kết tủa đem nung đến khối lượng không đổi:
+) Bảo toàn nguyên tố N: \({n_{AgN{O_3}b{\rm{d}}}} + 2{n_{Cu{{(N{O_3})}_2}b{\rm{d}}}} = 2{n_{Mg{{(N{O_3})}_2}(dd\,A)}} + 2{n_{Cu{{(N{O_3})}_2}(dd\,A)}}\)→ (1)
+) Chất rắn sau nung chứa MgO (x mol) và CuO (y mol) → mchất rắn (2)
Giải hệ (1) (2) được x và y
- Hỗn hợp kim loại ban đầu:
+) Bảo toàn nguyên tố Mg → \({n_{Mg(hh)}} = {n_{Mg{{(N{O_3})}_2}dd\,A}}\)
+) Bảo toàn nguyên tố Cu → \({n_{Cu(hh)}} = {n_{Cu{{(N{O_3})}_2}(dd\,A)}} + {n_{Cu(c{\rm{ran}}\,{\rm{B)}}}} - {n_{Cu{{(N{O_3})}_2}b{\rm{d}}}}\)
Từ đó tính m.
Lời giải chi tiết:
- Do cho A tác dụng với NaOH dư, lọc kết tủa đem nung thu được 2 oxit nên dd A có chứa Mg(NO3)2 và Cu(NO3)2 (không còn AgNO3)
- Do dd A chứa Cu(NO3)2 nên Mg hết → Chất rắn B chứa Cu, Ag
Sơ đồ tóm tắt:
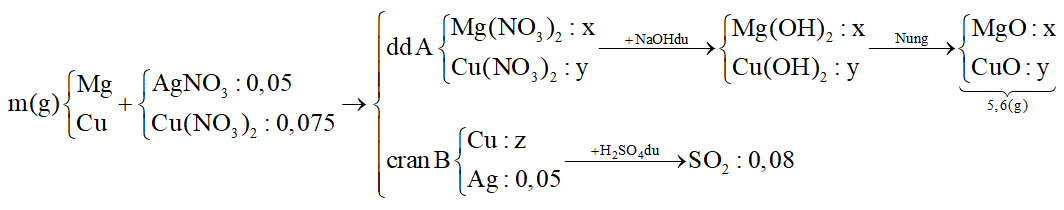
- Khi cho B tác dụng với H2SO4 đặc nóng:
Áp dụng bảo toàn e: \(2{n_{Cu(c{\rm{r}}an\,B)}} + {n_{Ag}} = 2{n_{S{O_2}}} \to 2.{n_{Cu(c{\rm{r}}an\,B)}} + 0,05 = 2.0,08 \to {n_{Cu(c{\rm{r}}an\,B)}} = 0,055\)
- Khi cho A tác dụng với NaOH dư lọc kết tủa đem nung đến khối lượng không đổi:
+) Bảo toàn nguyên tố N: \({n_{AgN{O_3}b{\rm{d}}}} + 2{n_{Cu{{(N{O_3})}_2}b{\rm{d}}}} = 2{n_{Mg{{(N{O_3})}_2}(dd\,A)}} + 2{n_{Cu{{(N{O_3})}_2}(dd\,A)}}\)
→ 0,05 + 0,075.2 = 2x + 2y (1)
+) Chất rắn sau nung chứa MgO (x mol) và CuO (y mol)
→ mchất rắn = 40x + 80y = 5,6 (2)
Giải hệ (1) (2) được x = 0,06 và y = 0,04
- Hỗn hợp kim loại ban đầu:
+) Bảo toàn nguyên tố Mg → \({n_{Mg(hh)}} = {n_{Mg{{(N{O_3})}_2}dd\,A}} = 0,06(mol)\)
+) Bảo toàn nguyên tố Cu → \({n_{Cu(hh)}} = {n_{Cu{{(N{O_3})}_2}(dd\,A)}} + {n_{Cu(c{\rm{ran}}\,{\rm{B)}}}} - {n_{Cu{{(N{O_3})}_2}b{\rm{d}}}} = 0,04 + 0,055 - 0,075 = 0,02(mol)\)
Vậy m = 0,06.24 + 0,02.64 = 2,72 gam
Đáp án A







