Câu hỏi
Hòa tan hoàn toàn 9,942 gam hỗn hợp gồm Al và Mg vào dung dịch HNO3 loãng, thu được dung dịch X và 3,136 lít (đktc) hỗn hợp Y gồm 2 khí không màu trong đó có một khí hóa nâu trong không khí, khối lượng của Y là 5,18 gam. Cô cạn cẩn thận dung dịch A thu được m gam chất rắn. Nung lượng chất rắn này đến khối lượng không đổi được 17,062 gam chất rắn. Giá trị gần đúng nhất của m là:
- A 62,333gam
- B 65,123gam
- C 66,323gam
- D 18,262gam
Phương pháp giải:
- Xét hỗn hợp khí Y: Khí không màu hóa nâu trong không khí là NO
→ MY = 5,18 : 0,14 = 37 → Khí còn lại có M > 37
→ Y có khí N2O và NO với số mol x và y mol → Lập hệ theo số mol và khối lượng của Y giải x và y
- Tóm tắt sơ đồ:
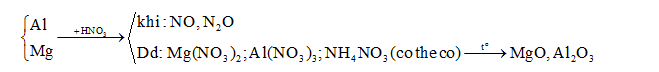
Đặt số mol Al và Mg lần lượt là a và b mol thì → pt (1)
Bảo toàn nguyên có có nAl2O3 = ½ a và nMgO = b mol → pt (2)
Giải hệ trên được a và b
- Bảo toàn electron: 3nAl + 2nMg = 3nNO + 8nN2O + 8nNH4NO3 → nNH4NO3
Lời giải chi tiết:
- Xét hỗn hợp khí Y: Khí không màu hóa nâu trong không khí là NO
→ MY = 5,18 : 0,14 = 37 → Khí còn lại là khí không màu có M > 37 (N2O)
Giả sử Y chứa N2O (x mol)và NO (y mol) → \(\left\{ \begin{array}{l}44{\rm{x}} + 30y = 5,18\\x + y = 0,14\end{array} \right. \to x = y = 0,07\,mol\)
- Sơ đồ tóm tắt:
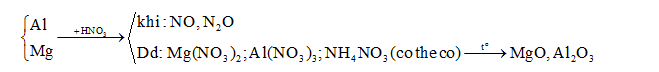
Đặt số mol Al và Mg lần lượt là a và b mol:
+ m hh = 27a + 24b = 9,942 (1)
+ Chất rắn sau nung chứa: nAl2O3 = 0,5nAl = 0,5a (mol) và nMgO = nMg = b (mol) (Áp dụng bảo toàn nguyên tố)
→ m chất rắn = 51a + 40b = 17,062 (2)
Giải hệ trên được a = 0,082 mol và b = 0,322 mol
Bảo toàn electron: 3nAl + 2nMg = 3nNO + 8nN2O + 8nNH4NO3
→ 3.0,082 + 2.0,322 = 3.0,07 + 8.0,07 + 8nNH4NO3
→ nNH4NO3 = 0,015 mol
→ Khi cô cạn dung dịch thu được: 0,015 mol NH4NO3; 0,082 mol Al(NO3)3 và 0,322 mol Mg(NO3)2
→ m = 0,015.80 + 0,082.213 + 0,322.148 = 66,322 gam gần nhất với 66,323 gam
Đáp án C







