Câu hỏi
Cho 24,94 gam hỗn hợp gồm CuSO4 và KCl vào nước dư, thu được dung dịch X. Tiến hành điện phân dung dịch X bằng điện cực trơ, màng ngăn xốp với cường độ dòng điện I = 5A trong thời gian t giây, thấy khối lượng dung dịch giảm 9,7 gam so với dung dịch X ban đầu. Mặt khác nếu điện phân trong thời gian 1,5t giây thấy khối lượng catot tăng 6,4 gam và thu được dung dịch Y. Dung dịch Y hòa tan tối đa m gam Al2O3. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m và t lần lượt là
- A 1,36 và 3088.
- B 2,04 và 4632.
- C 2,04 và 3088.
- D 2,04 và 3088.
Phương pháp giải:
Lập luận để thấy được tại thời gian 1,5t giây Cu2+ đã điện phân hết hoàn toàn
=> nCuSO4 bđ = 0,1 (mol); nKCl = 0,12 (mol)
Viết các bán phản ứng xảy ra tại mối điện cực trong thời gian t giây và 1,5t giây
Sử dụng bảo toàn e vào quá trình tính toán
Chú ý: Al2O3 có thể tan được cả trong môi trường H+ hoặc OH-
Lời giải chi tiết:
- Xét thời gian điện phân là 1,5t giây
mcatot tăng = mCu = 6,4 (g) → nCu = 6,4 : 64 = 0,1 (mol)
+ Giả sử tại 1,5t giây catot Cu2+ chưa điện phân hết → Anot có Cl- và H2O phải bị điện phân (Vì dd Y sau pư hòa tan được Al2O3)
→ ne trao đổi = 2nCu = 0,2 (mol)
→ Tại thời gian t giây → ne trao đổi = 0,2/1,5 = 2/15 (mol)
áp dụng công thức ta có:\(ne\,trao\,doi = \frac{{I.t}}{F} \to \frac{2}{{15}} = \frac{{5.t}}{{96500}} \to t = 2573,33\) → loại vì không có đáp án t phù hợp
+ Giả sử tại 1,5t giây catot Cu2+ điện phân hết có H2O điện phân và Anot có Cl- và H2O phải bị điện phân
→ nCuSO4 ban đầu = nCu = 0,1 (mol)
BTKL: mCuSO4 ban đầu + mKCl ban đầu = 24,94 (g) → mKCl bđ = 24,94 - 0,1.160 = 8,94 (g) → nKCl bđ = 0,12 (mol)
Ta thấy: mCu tối đa + mCl2 tối đa = 0,1.64 + 0,06.71 = 10,66 (g)
và 2nCu = 0,2 (mol) > nCl- = 0,12 (mol), do vậy nếu Cl- điện phân hết thì
mgiảm = mCu sinh ra+ mCl2 đp = 0,06.64+ 0,06.71 = 8,1 (g)
Mà đề bài cho 8,1 (g) < mgiảm = 9,7 (g) < 10,66 (g)
Do vậy tại t giây Cu2+ điện phân chưa hết, Cl- điện phân hết và bên anot có H2O điện phân

Ta có hệ PT:
\(\left\{ \begin{gathered}
\xrightarrow{{BT:e}}2{n_{Cu}} = 2{n_{C{l_2}}} + 4{n_{{O_2}}} \hfill \\
m{\,_{dd\,giam}} = {m_{Cu}} + {m_{C{l_2}}} + {m_{{O_2}}} \hfill \\
\end{gathered} \right. \to \left\{ \begin{gathered}
2a = 0,12 + 4b \hfill \\
9,7 = 64a + 0,06.71 + 32b \hfill \\
\end{gathered} \right. \to \left\{ \begin{gathered}
a = 0,08 = {n_{Cu\,d}}_p \hfill \\
b = 0,01 = {n_{{O_2}}} \hfill \\
\end{gathered} \right.\)
→ ne trao đổi = 2nCu đp = 2a = 0,16 (mol)
áp dụng công thức ta có:\(ne\,trao\,doi = \frac{{I.t}}{F} \to 0,16 = \frac{{5.t}}{{96500}} \to t = 3088\,(s)\)
- Xét tại 1,5t giây → ne trao đổi = 1,5. 0,16 = 0,24 (mol)
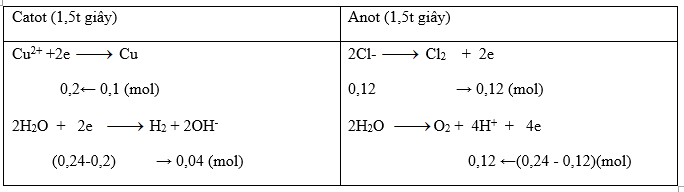
Vì H+ + OH- → H2O
0,04 ← 0,04 (mol)
→ dd Y thu được chứa: H+ dư = 0,12 - 0,04 = 0,08 (mol)
6H+ + Al2O3 → 2Al3+ + 3H2O
0,08 →1/75 (mol)
→ mAl2O3 = 1/75.102 = 1,36 (g)
Vậy m = 1,36 (g) và t = 3088 (s)
Đáp án A







