Câu hỏi
Điện phân dung dịch Cu(NO3)2 với điện cực trơ, cường độ dòng điện 5A. Sau thời gian t giây, khối lượng dung dịch giảm m gam và catot chỉ thu được kim loại. Sau thời gian 2t giây, khối lượng dung dịch giảm (m + 3,56) gam ( biết m > 3,56) và thu được dung dịch X. Biết X hòa tan tối đa 4,20 gam Fe (sản phẩm khử duy nhất của N+5 là NO). Coi lượng nước bay hơi không đáng kể trong quá trình điện phân và bỏ qua sự hòa tan của khí trong nước. Giá trị của t là
- A 2316
- B 2895
- C 5018
- D 7720
Phương pháp giải:
Nếu tại 2t giây Cu2+ điện phân chưa hết thì m dd giảm (2t) = 2.m dd giảm (t) = 2m (gam)
Hay 2m = m + 3,56 => m = 3,56 trái với giả thiết đề bài là m > 3,56 gam
Vậy tại 2t giây Cu2+ đã bị điện phân hết, H2O đang bị điện phân
HS viết các quá trình điện phân ở các điện cực. Dựa theo khối lượng dung dịch giảm ở 2 thời điểm lập hệ phương trình và giải.
Lời giải chi tiết:
nFe = 0,075 mol
Nếu tại 2t giây Cu2+ điện phân chưa hết thì m dd giảm (2t) = 2.m dd giảm (t) = 2m (gam)
Hay 2m = m + 3,56 => m = 3,56 trái với giả thiết đề bài là m > 3,56 gam
Vậy tại 2t giây Cu2+ đã bị điện phân hết, H2O đang bị điện phân
*Do X hòa tan tối đa Fe nên phản ứng tạo muối Fe2+ (HS hiểu rằng khi Fe tác dụng với {H+, NO3-} sinh ra Fe3+, mà Fe3+ có thể hòa tan thêm Fe tạo Fe2+).
3Fe + 8H+ + 2NO3- → 3Fe2+ + 2NO + 4H2O
0,075 → 0,2 mol
Như vậy dd sau đp gồm: H+ (0,2 mol) và NO3- (0,2 mol)
BTNT "N": nCu(NO3)2 bđ = 1/2.nNO3- = 0,2/2 = 0,1 mol
*Tại t (giây): Đặt ne = b (mol)
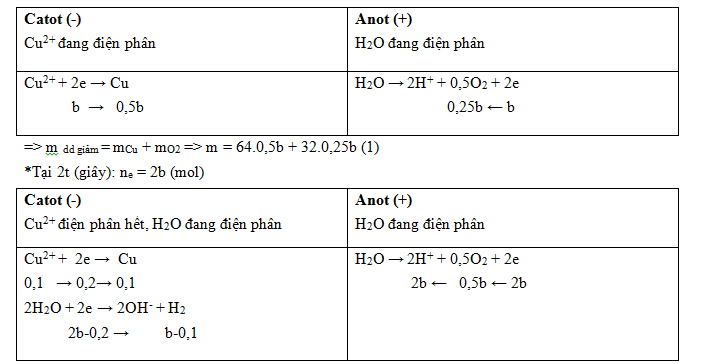
m dd giảm = mCu + mH2 + mO2 => m + 3,56 = 0,1.64 + 2(b-0,1) + 32.0,5b (2)
Từ (1) và (2) có hệ: \(\left\{ \begin{gathered}{\text{m }} = {\text{ }}64.0,5b{\text{ }} + {\text{ }}32.0,25b{\text{ }}\left( 1 \right) \hfill \\{\text{m }} + {\text{ }}3,56{\text{ }} = {\text{ }}0,1.64{\text{ }} + {\text{ }}2\left( {b - 0,1} \right){\text{ }} + {\text{ }}32.0,5b{\text{ }}\left( 2 \right) \hfill \\\end{gathered} \right. \to \left\{ \begin{gathered}m - 8,32b = 0 \hfill \\m - 18b = 2,64 \hfill \\\end{gathered} \right. \to \left\{ \begin{gathered}m = 4,8 \hfill \\b = 0,12 \hfill \\\end{gathered} \right.\)
=> ne (t giây) = b = 0,12 mol
=> t = ne.F/I = 0,12.96500/5 = 2316 giây
Đáp án A







