1. Tốc độ phản ứng là gì?
- Tốc độ phản ứng của một phản ứng hoá học là biến thiên nồng độ của một trong các chất phản ứng hoặc sản phẩm trong một đơn vị thời gian (v) (tốc độ trung bình).
- Tốc độ trung bình của một phản ứng hoá học là tốc độ được tính trong một khoảng thời gian.
- Tốc độ tức thời của một phản ứng hoá học là tốc độ được tính trong một khoảng thời gian vô cùng ngắn.
2. Ảnh hưởng của nồng độ đến tốc độ phản ứng
- Ảnh hưởng của nồng độ đến tốc độ phản ứng có thể giải thích như sau: trong quá trình phản ứng, các hạt (phân tử, nguyên tử hoặc ion) luôn chuyển động không ngừng và va chạm với nhau. Những va chạm có năng lượng đủ lớn phá vỡ liên kết cũ và hình thành liên kết mới dẫn tới phản ứng hoá học, được gọi là va chạm hiệu quả.
- Khi nồng độ chất phản ứng tăng lên, số va chạm giữa các hạt tăng lên, làm số va chạm hiệu quả cũng tăng lên và dẫn đến tốc độ phản ứng tăng.
- Giải thích ảnh hưởng của áp suất đến tốc độ phản ứng
Trong hỗn hợp khí: CM = \(\frac{{{\rm{n = const}}}}{{\rm{V}}}\)
Khi áp suất tăng => thì phải nén thể tích lại (Vgiảm) => CM tăng => Tốc độ phản ứng tăng.
3. Ảnh hưởng của nhiệt độ đến tốc độ phản ứng
- Ở nhiệt độ thường, các chất phản ứng chuyển động với tốc độ nhỏ; khi tăng nhiệt độ, các hạt (phân tử, nguyên tử hoặc ion) sẽ chuyển động nhanh hơn, động năng cao hơn. Khi đó, số va chạm hiệu quả giữa các hạt tăng lên, dẫn đến tốc độ phản ứng tăng.
- Khi các chất phản ứng va chạm đúng hướng và đủ năng lượng dẫn đến xảy ra phản ứng gọi là va chạm có hiệu quả.
- Thực nghiệm cho thấy khi tăng nhiệt độ lên 10°C thì tốc độ phản ứng thường tăng từ 2 đến 4 lần. Số lần tăng này được gọi là hệ số nhiệt độ Van’t Hoff, ký hiệu \(\gamma \).
- Biểu thức liên hệ giữa nhiệt độ và tốc độ phản ứng hoá học
\(\frac{{{v_2}}}{{{v_1}}} = {\gamma ^{\frac{{{t_2} - {t_1}}}{{10}}}}\)
Trong đó: \(\gamma \)= 2 đến 4 (nếu tăng 10oC): hệ số nhiệt độ Van’t Hoff.
\({\nu _{_1}},{\nu _{_2}}\) là tốc độ phản ứng ở 2 nhiệt độ t1 và t2
- Quy tắc Van’t Hoff chỉ gần đúng trong khoảng nhiệt độ không cao.
- Giá trị \(\gamma \) càng lớn thì ảnh hưởng của nhiệt độ đến tốc độ phản ứng càng mạnh4. Ảnh hưởng của diện tích bề mặt đến tốc độ phản ứng
- Khi tăng diện tích bề mặt tiếp xúc, số va chạm giữa các chất đầu tăng lên, số va chạm hiệu quả cũng tăng theo, dẫn đến tốc độ phản ứng tăng.
- Nếu kích thước hạt càng nhỏ thì tổng diện tích bề mặt càng lớn, nên có thể tăng diện tích tiếp xúc bằng cách đập nhỏ hạt. Ngoài ra, có thể tăng diện tích bề mặt của một khối chất bằng cách tạo nhiều đường rãnh, lỗ xốp trong lòng khối chất đó (tương tự như miếng bọt biển). Khi đó diện tích bề mặt bao gồm diện tích bề mặt trong và diện tích bề mặt ngoài.
5. Ảnh hưởng của chất xúc tác đến tốc độ phản ứng
- Ảnh hưởng của xúc tác đến tốc độ phản ứng được giải thích dựa vào năng lượng hoạt hoá. Đây là năng lượng tối thiểu cần cung cấp cho các hạt (nguyên tử, phân tử hoặc ion) để va chạm giữa chúng gây ra phản ứng hoá học.
- Khi có xúc tác, phản ứng sẽ xảy ra qua nhiều giai đoạn. Mỗi giai đoạn đều có năng lượng hoạt hoá thấp hơn so với phản ứng không xúc tác. Do đó số hạt có đủ năng lượng hoạt hoá sẽ nhiều hơn, dẫn đến tốc độ phản ứng tăng lên.
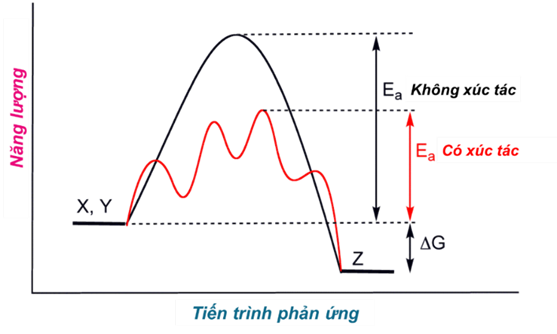
Năng lượng hoạt hoá của phản ứng khi không có xúc tác là A và khi có xúc tác với năng lượng hoạt hoá là B, c của các giai đoạn
- Sau phản ứng, khối lượng, bản chất hoá học của chất xúc tác không đổi, tuy nhiên, kích thước, hình dạng hạt, độ xốp,... có thể thay đổi.
6. Một số ví dụ về ứng dụng của các yếu tố làm ảnh hưởng đến tốc độ phản ứng
1. Trong hàn xì, đốt acetylene bằng oxygen nguyên chất cháy nhanh và cho nhiệt độ cao hơn khi đốt bằng oxygen trong không khí => tăng nồng độ oxygen => tốc độ phản ứng tăng.
2. Thực phẩm nấu trong nồi áp suất sẽ nhanh chín hơn so với khi nấu ở áp suất thường => tăng nhiệt độ => tốc độ phản ứng tăng.
3. Bảo quản thức ăn trong tủ lạnh để thức ăn lâu bị ôi thiu => giảm nhiệt độ => tốc độ phản ứng giảm.
4.Các chất đốt rắn như than củi nếu dùng cùng một khối lượng mà có kích thước nhỏ sẽ cháy nhanh hơn => tăng diện tích tiếp xúc=> tốc độ phản ứng tăng.
5. Rắc men vào tinh bột đã được nấu chín (cơm, ngô, khoai, sắn, …) để ủ rượu => dùng chất xúc tác=> tốc độ phản ứng tăng.

 Tốc độ phản ứng - Từ điển Hoá 10
Tốc độ phản ứng - Từ điển Hoá 10 






Danh sách bình luận