Vì sao các hợp chất ion thường tồn tại ở trạng thái rắn và cứng trong điều kiện thường, nhưng lại giòn, dễ vỡ?
- Cấu trúc tinh thể và lực hút tĩnh điện để giải thích trạng thái rắn và cứng trong điều kiện thường
- Điện tích trái dấu của các ion để giải thích tính chất giòn và dễ vỡ
- Do các hợp chất ion có cấu trúc tinh thể và lực hút tĩnh điện mạnh nên chúng thường tồn tại ở trạng thái rắn và cứng trong điều kiện thường.
- Khi bị một lực tác động, do các ion có điện tích trái dấu nên cứ một lớp ion bị dịch chuyển sẽ kéo theo toàn bộ sự sắp xếp bị dịch chuyển theo khiến mạng tinh thể bị vỡ

Các bài tập cùng chuyên đề
b) Hợp chất ion dẫn điện trong trường hợp nào? Vì sao?
Thử tính dẫn điện của hợp chất
Chuẩn bị: muối ăn dạng hạt, dung dịch muối ăn bão hòa, dung dịch nước đường, dụng cụ thử tính dẫn điện, cốc thủy tinh.
Tiến hành: Sử dụng dụng cụ thử tính dẫn điện như Hình 11.3, lần lượt cho chân kim loại của dụng cụ thử tính dẫn điện tiếp xúc với:
- Dung dịch nước đường
- Muối ăn khan.
- Dung dịch muối ăn bão hòa.
Nếu đèn sáng thì chất dẫn điện nếu đèn không sáng thì chất không dẫn điện.
Quan sát hiện tượng và cho biết trường hợp nào dẫn điện, trường hợp nào không dẫn điện. Giải thích.

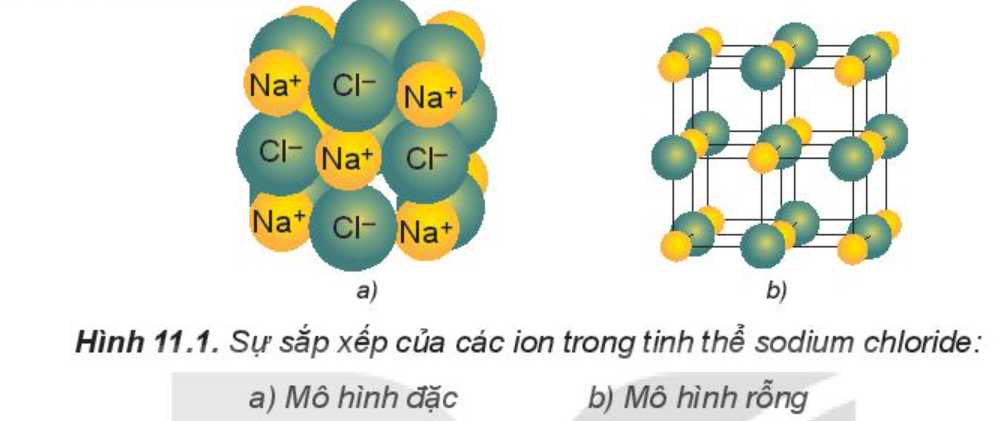
Lắp ráp mô hình tinh thể NaCl
Chuẩn bị: bộ mô hình tinh thể NaCl.
Tiến hành:
- Chọn hình cầu có màu sắc khác nhau đại diện cho ion Na+ và ion Cl-.
- Lắp các hình cầu và que nối theo mẫu (Hình 11.1b).
Quan sát mô hình và xác định số ion gần nhất bao quanh một ion trái dấu ở giữa mô hình.
Lắp ráp mô hình tinh thể NaCl: Quan sát Hình 10.2b để lắp ráp mô hình tinh thể NaCl từ các quả cầu minh họa cho Na+, Cl- và que nối
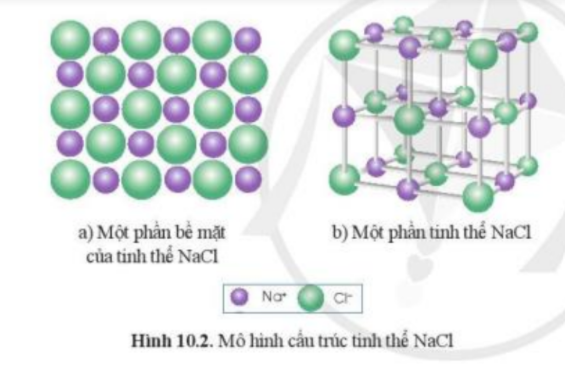
Từ mô hình NaCl, hãy cho biết xung quanh mỗi ion Na+ có bao nhiêu ion Cl- (ở gần nhất với Na+)?
a) Giải thích vì sao bán kính nguyên tử Na, Mg lớn hơn bán kính các ion kim loại tương ứng
b) Vì sao cả Na2O và MgO đều là chất rắn ở nhiệt độ thường?
c) Vì sao nhiệt độ nóng chảy của MgO (2 852oC) cao hơn rất nhiều so với Na2O (1 132oC)?
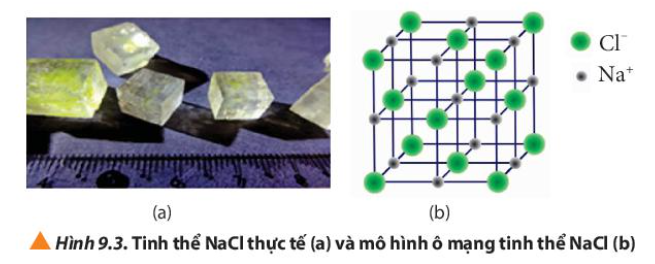
Quan sát Hình 9.3, cho biết:
a) Tinh thể NaCl có cấu trúc của hình khối nào.
b) Các ion Na+ và Cl- phân bố trong tinh thể như thế nào
c) Xung quanh mỗi loại ion có bao nhiêu ion ngược dấu gần nhất
Em hiểu thế nào về tinh thể ion?
Quan sát các bước trong Hình 9.4, cho biết cần bao nhiêu thanh nối và khối cầu mỗi loại để lắp ráp thành mô hình một ô mạng tinh thể NaCl
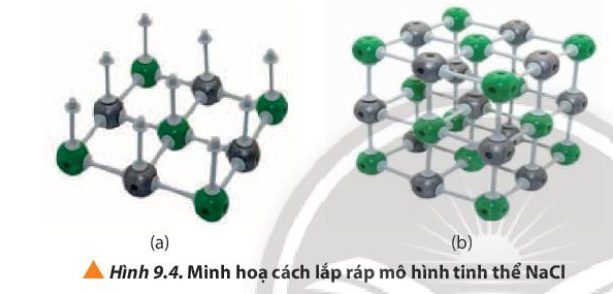
Vì sao nói sodium chloride có cấu trúc mạng tinh thể kiểu lập phương tâm diện?
Hình dạng và cấu trúc tinh thể của mọi hợp chất ion có giống nhau không? Giải thích.
Cho biết lực hút tĩnh điện được tính theo công thức sau: F = \(k\frac{{\left| {{q_1}} \right|\left| {{q_2}} \right|}}{{{r^2}}}\) (q1, q2 là giá trị điện tích của hai điện tích điểm, đơn vị là C (coulomb); r là khoảng cách giữa hai điện tích điểm, đơn vị là m (meter); k là hằng số coulomb). Dựa vào công thức trên, hãy so sánh gần đúng lực hút tĩnh điện giữa các ion trái dấu trong phân tử NaCl và phân tử MgO. Từ đó, cho biết nhiệt độ nóng chảy và nhiệt độ sôi của hợp chất nào cao hơn.
Trình bày cách vẽ một ô mạng tinh thể NaCl
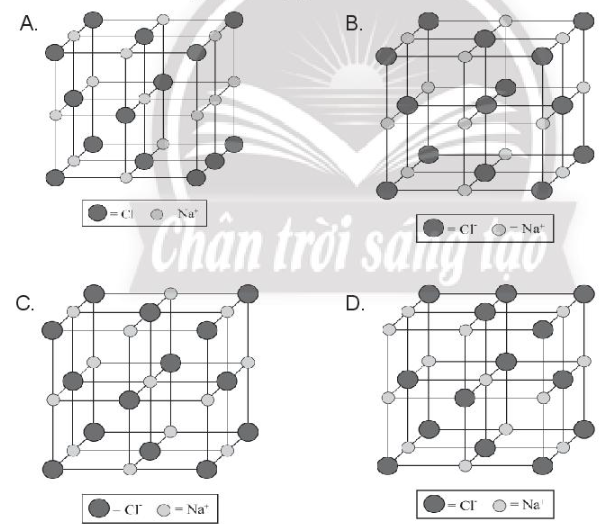
Chỉ ra cấu trúc đúng của ô mạng tinh thể sodium chloride:
Vì sao các hợp chất ion thường là chất rắn ở nhiệt độ phòng?
Lithium fluoride (LiF) và sodium chloride (NaCl) đều là các hợp chất ion. Dự đoán nhiệt độ sôi và nhiệt độ nóng chảy của chất nào cao hơn. Giải thích.
Cho các phát biểu sau về hợp chất ion:
(a) Không dẫn điện khi nóng chảy.
(b) Khá mềm.
(c) Có nhiệt độ nóng chảy và nhiệt độ sôi cao.
(d) Khó tan trong nước và các dung môi phân cực.
Số phát biểu đúng là
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Cho các phát biểu sau về hợp chất ion:
(1) Không dẫn điện khi nóng chảy.
(2) Dễ hòa tan trong các dung môi hữu cơ.
(3) Có nhiệt độ nóng chảy và nhiệt độ sôi cao.
(4) Khó tan trong nước.
Số phát biểu đúng là
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Trong các sản phẩm sau, sản phẩm nào không phải là sản phẩm của hóa học?
-
A.
Phân bón hóa học.
-
B.
Thuốc.
-
C.
Dầu gội đầu.
-
D.
Thực phẩm biến đổi gen.







Danh sách bình luận