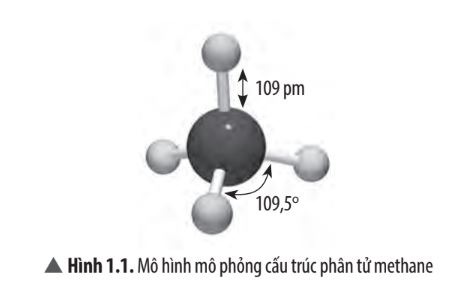
Vì sao góc liên kết HCH trong phân tử methane không thể là 90o?
- Để giảm tối đa lực đẩy giữa 4 cặp electron chung
Vì xung quanh nguyên tử C có 4 cặp electron chung. Để giảm tối đa lực đẩy giữa 4 cặp electron chung, 4 cặp electron này phải chiếm 4 khu vực điện tích âm sao cho lực đẩy giữa chúng là nhỏ nhất nên phân tử có dạng tứ diện, góc liên kết \(\widehat {HCH}\) = 109,5o

Các bài tập cùng chuyên đề
Viết công thức Lewis, dự đoán dạng hình học của phân tử CH4
Giải thích vì sao khi xung quanh nguyên tử trung tâm có 3 đám mây electron hóa trị E thì 3 đám mây này có xu hướng nằm ở 3 đỉnh của một tam giác phẳng.
Sử dụng mô hình VSEPR để dự đoán hình học của phân tử CS2
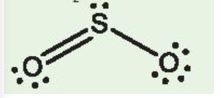
Xác định giá trị n, m trong công thức VSEPR của phân tử SO2. Cho biết công thức Lewis của SO2 là
Thực hiện Bước 3 cho phân tử BF3 và cho biết có cần tiếp tục Bước 4?
Xác định nguyên tử trung tâm trong BF3. Lập sơ đồ khung của phân tử BF3.
Hình học phân tử (hình dạng phân tử) của một chất rất quan trọng trong việc xác định cách thức phân tử chất đó tương tác và phản ứng với các phân tử chất khác. Hình học phân tử cũng ảnh hưởng đến nhiệt độ sôi và nhiệt độ nóng chảy của chất. Nhiều đặc tính của chất được giải thích từ dữ liệu hình học phân tử của nó.
Yếu tố nào quyết định hình học phân tử các chất?
Dự đoán dạng hình học của một số phân tử sau: CO2, CS2, BF3, SCl2
Dạng hình học của ion NH4+ là
A. tứ diện đều
B. tháp tam giác
C. tam giác phẳng
D. đường thẳng
Viết công thức theo mô hình VSEPR và cho biết dạng hình học của phân tử OF2. Phân tử này có phân cực không?
Công thức của PCl3 theo mô hình VSEPR là
A. AX3
B. AXE2
C. AX3E
D. AX2E








Danh sách bình luận