Quan sát Bảng 19.1, hãy cho biết đặc điểm cấu hình electron của các nguyên tử kim loại chuyển tiếp dãy thứ nhất.
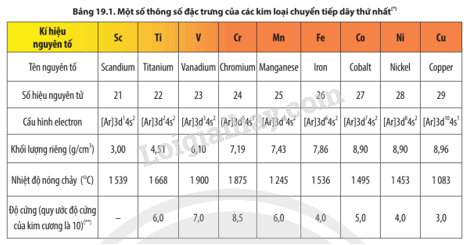
Cấu hình electron nguyên tử của các nguyên tố kim loại chuyển tiếp dãy thứ nhất có dạng [Ar]3d1÷10 4s1÷2. Nguyên tử của các nguyên tố kim loại chuyển tiếp dãy thứ nhất có electron hoá trị nằm ở phân lớp 3d và 4s.

Các bài tập cùng chuyên đề
Trong bảng tuần hoàn, các nguyên tố kim loại chuyển tiếp dãy thứ nhất thuộc khối s, p, d hay f?
Nhận xét chung về cấu hình electron của nguyên tử kim loại chuyển tiếp dãy thứ nhất về:
a) Đặc điểm giống nhau và khác nhau trong cấu hình electron nguyên tử.
b) Sự biến đổi số electron trên phân lớp 3d và 4s.
Đặc điểm cấu hình electron nguyên tử kim loại chuyển tiếp dãy thứ nhất có gì khác biệt với nhóm IA và IIA trong cùng chu kì?
Cấu hình electron của Fe2+ là
A. 1s22s22p63s23p63d64s2. B. 1s22s22p63s23p63d6.
C. 1s22s22p63s23p64s23d6. D. 1s22s22p63s23p63d44s2.
Phát biểu nào sau đây đúng?
A. Cấu hình electron của nguyên tử kim loại chuyển tiếp dãy thứ nhất đều có phân lớp 3d chưa bão hoà.
B. Tất cả các nguyên tố chuyển tiếp dãy thứ nhất đều là kim loại.
C. Tất cả các nguyên tố thuộc nhóm B, chu kì 4 đều là nguyên tố chuyển tiếp dãy thứ nhất.
D. Tất cả các kim loại chuyển tiếp dãy thứ nhất đều là kim loại nặng.
Kim loại chuyển tiếp dãy thứ nhất gồm 9 nguyên tố Sc (Z=21) đến Cu (Z=29) trong bảng tuần hoàn các nguyên tố hóa học. Các nguyên tố này thường thể hiện nhiều trạng thái oxi hóa khác nhau. Chẳng hạn, nguyên tố sắt (Z=26) có số oxi hóa +2 trong hợp chất FeCl2 có số oxi hóa +3 trong hợp chất FeCl3.
a) Vì sao kim loại chuyển tiếp dãy thứ nhất thường tạo được nhiều hợp chất với các số oxi hóa dương khác nhau?
b) Nêu một số tính chất và ứng dụng của đơn chất kim loại chuyển tiếp dãy thứ nhất.
Dựa vào Bảng 20.1, giải thích vì sao nhiều kim loại chuyển tiếp dãy thứ nhất thường có số oxi hóa +2 trong các hợp chất.
Xác định số oxi hóa của sắt trong các hợp chất sau: FeO, Fe2O3, Fe3O4 (hay FeO.Fe2O3)
a) Từ Bảng 20.1, hãy chỉ ra xu hướng biến đổi về số electron hóa trị của các nguyên tử nguyên tố từ scandium đến cobalt.
b) Từ Bảng 20.4, hãy chỉ ra xu hướng biến đổi về khối lượng riêng của các kim loại từ scandium đến đồng.
Potassium là nguyên tố họ s, thuộc cùng chu kì 4 với các nguyên tố chuyển tiếp dãy thứ nhất.
Từ Bảng 17.1 và Bảng 20.4, hãy chỉ ra sự khác biệt về khối lượng riêng, độ cứng và nhiệt độ nóng chảy giữa các kim loại chuyển tiếp dãy thứ nhất với kim loại potassium.
Trong bảng tuần hoàn các nguyên tố hoá học, kim loại chuyển tiếp dãy thứ nhất bao gồm các nguyên tố từ Sc đến Cu. Cấu hình electron của nguyên tử các nguyên tố này có đặc điểm gì? Chúng có những tính chất vật lí và ứng dụng nào?
Hãy viết cấu hình electron của các ion: Cu2+, Fe3+, Cr3+, Mn2+.
Viết cấu hình electron của các ion: Cr2+, Fe2+, Ni2+, Co2+, Co3+.
Ở trạng thái cơ bản, cấu hình electron của nguyên tử nào sau đây có phân lớp 3d bão hòa?
-
A.
Sc( Z=21)
-
B.
Cu(Z=29)
-
C.
Ni(Z=28)
-
D.
Mn(Z=25)
Nguyên tố nào sau đây không thể hiện xu hướng có nhiều số oxi hóa trong hợp chất?
-
A.
Cr
-
B.
Mn
-
C.
Fe
-
D.
Mg
Cho phát biểu "Nguyên tố kim loại chuyển tiếp dãy thứ nhất tạo nhiều hợp chất mà trong đó chúng có các số oxi hoá dương khác nhau, đó là do nguyên tố này có ...(1)... và nguyên tử của chúng có ...(2)...."
Cụm từ cần điền vào (1) và (2) lần lượt là:
-
A.
độ âm điện bé, nhiều electron hoá trị.
-
B.
độ âm điện lớn, nhiều electron hoá trị.
-
C.
điện tích hạt nhân lớn, bán kính bé.
-
D.
bán kính bé, điện tích hạt nhân lớn.
Khi so sánh kim loại Fe với Ca, nhận định nào sau đây không đúng?
-
A.
Có khối lượng riêng lớn hơn
-
B.
Có độ cứng cao hơn
-
C.
Có tính khử mạnh hơn
-
D.
Có nhiệt độ nóng chảy cao hơn
Khi so sánh nguyên tử Ti với K, nhận định nào sau đây không đúng?
-
A.
Có bán kính lớn hơn
-
B.
Có số elctron hóa trị nhiều hơn
-
C.
Có số electron độc thân nhiều hơn
-
D.
Có độ âm điện lớn hơn.
Trong dãy nguyên tử Sc, Ti, V, Cr bán kính nguyên tử thay đổi như thế nào?
-
A.
Tăng dần
-
B.
Không đổi
-
C.
Giảm dần
-
D.
Không có quy luật
Các hợp chất ứng với số oxi hóa cao nhất của Cr có tính oxi hóa mạnh. Giá trị thế điện cực chuẩn nào sau đây thuộc về cặp Cr2O72- , H+/Cr3+
-
A.
-0.44V
-
B.
-2,93V
-
C.
0V
-
D.
+1,36V
Phát biểu nào sau đây không đúng?
-
A.
Các nguyên tố kim loại chuyển tiếp dãy thứ nhất thuộc khối d.
-
B.
Zn là nguyên tử kim loại chuyển tiếp dãy thứ nhất có phân lớp 3d đã điền đầy electron.
-
C.
Nguyên tử các kim loại chuyển tiếp dãy thứ nhất đều có lớp vỏ bên trong của khí hiếm Ar.
-
D.
Kim loại chuyển tiếp dãy thứ nhất thường tạo thành các hợp chất với nhiều số oxi hóa khác nhau.
Phát biểu nào sau đây không đúng?
-
A.
Tất cả các nguyên tố thuộc nhóm B đều là nguyên tố chuyển tiếp dãy thứ nhất.
-
B.
Các nguyên tố chuyển tiếp dãy thứ nhất thường có nhiệt độ nóng chảy cao hơn các kim loại nhóm IA và IIA.
-
C.
Số oxi hóa của nguyên tử nguyên tố chromium trong hợp chất K2CrO4 và K2Cr2O7 bằng nhau
-
D.
Trạng thái oxi hóa thường gặp của Mn là +2, +4,+ 7.
Nhận xét nào sau đây là đúng?
-
A.
Sắt thuộc nhóm kim loại nặng và có nhiệt độ nóng chảy cao nhất trong dãy kim loại chuyển tiếp thứ nhất.
-
B.
Trong số các kim loại chuyển tiếp dãy thứ nhất, chromium có nhiệt độ nóng chảy cao nhất.
-
C.
Chromium có độ cứng cao nên được dùng mạ lên các thiết bị để chống mài mòn.
-
D.
Các đơn chất kim loại có khối lượng riêng lớn sẽ có độ cứng cao.
Xét các kim loại chuyển tiếp dãy thứ nhất.
a. Độ cứng của Cr > V > Mn.
b. V là nguyên tố thuộc nhóm VA.
c. Nikel được dùng để chế tạo thép không gỉ.
d. Nikel dùng chế pin sạc, như pin nickel kim loại hydride (NiMH) và pin nickel-cadmi (NiCd).
Số electron độc thân của nguyên tử cobalt \(({\rm{Z}} = 27)\) là bao nhiêu?
Số electron hoá trị của nguyên tử sắt \((Z = 26)\) là bao nhiêu?
Những đặc điểm nào sau đây là của nguyên tố kim loại chuyển tiếp dãy thứ nhất?
(a) Có các electron hoá trị phân bố cả trên phân lớp \(3\;{\rm{d}}\) và phân lớp \(4\;{\rm{s}}\).
(b) Từ \(_{21}{\rm{Sc}}\) đến \(_{29}{\rm{Cu}}\), số electron trong phân lớp \({\rm{d}}\) có xu hướng tăng dần (trừ trường hợp ngoại lệ).
(c) Thể hiện nhiều số oxi hoá dương hoặc âm trong các hợp chất.
(d) Tạo nên nhiều cation và anion có điện tích khác nhau.0
Cho phát biểu "Nguyên tố kim loại chuyển tiếp dãy thứ nhất tạo nhiều hợp chất mà trong đó chúng có các số oxi hoá dương khác nhau, đó là do nguyên tố này có ...(1)... và nguyên tử của chúng có ...(2)...."
Cụm từ cần điền vào (1) và (2) lần lượt là:
A. độ âm điện bé, nhiều electron hoá trị.
B. độ âm điện lớn, nhiều electron hoá trị.
C. điện tích hạt nhân lớn, bán kính bé.
D. bán kính bé, điện tích hạt nhân lớn.
Cấu hình electron của các ion Cr3+, Co3+, Fe3+ lần lượt là
A. [Ar]3d3, [Ar]3d6, [Ar]3d5. B. [Ar]3d3, [Ar]3d5, [Ar]3d6.
C. [Ar]3d5, [Ar]3d6, [Ar]3d3. D. [Ar]3d3, [Ar]3d7, [Ar]3d5.
Các nguyên tố kim loại chuyển tiếp không cùng dãy thứ nhất là
A. Sc, Ni, Ti. B. Fe, Mn, Co. C. Cr, Cu, V. D. Ni, Cu, Ag.







Danh sách bình luận