 Giải khoa học tự nhiên 8, soạn sgk khtn lớp 8 cánh diều
Giải khoa học tự nhiên 8, soạn sgk khtn lớp 8 cánh diều
 Chủ đề 1. Phản ứng hóa học - KHTN 8 Cánh diều
Chủ đề 1. Phản ứng hóa học - KHTN 8 Cánh diều
Bài 6. Nồng độ dung dịch trang 36, 37, 38, 39 ,40 Khoa học tự nhiên 8 Cánh diều
Khi hoà chất rắn vào nước, có chất tan nhiều, có chất tan ít, có chất không tan trong nước. Làm thế nào để so sánh khả năng hoà tan trong nước của các chất và xác định khối lượng chất tan có trong một dung dịch?
CH tr 36 MĐ
Khi hoà chất rắn vào nước, có chất tan nhiều, có chất tan ít, có chất không tan trong nước. Làm thế nào để so sánh khả năng hoà tan trong nước của các chất và xác định khối lượng chất tan có trong một dung dịch?
Phương pháp giải:
Lời giải chi tiết:
- Để so sánh khả năng hoà tan trong nước của các chất ta dựa vào độ tan của từng chất trong nước.
- Để xác định khối lượng chất tan trong một dung dịch có nhiều cách, như:
+ Dựa vào khối lượng dung dịch và khối lượng dung môi:
m chất tan = m dung dịch – m dung môi
Dựa vào nồng độ phần tram và khối lượng dung dịch:
m chất tan = (C% x m dd) : 100
+ Dựa vào nồng độ mol, thể tích dung dịch và khối lượng mol chất tan.
n = CM : V (mol); m = n x M (gam)
CH tr 36 CH1
Dung dịch bão hoà là gì?
Phương pháp giải:
Dựa vào kiến thức đã được học về dung dịch để trả lời câu hỏi
Lời giải chi tiết:
Dung dịch không thể hoà tan thêm chất tan được nữa gọi là dung dịch bão hoà.
CH tr 36 CH2
Tính khối lượng sodium chloride cần hoà tan trong 200 gam nước ở 20 oC để thu được dung dịch sodium chloride bão hoà.
Phương pháp giải:
Dựa vào công thức tính độ tan của 1 chất ở nhiệt độ xác định:
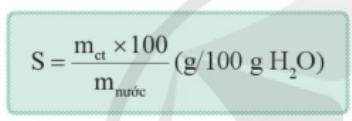
Trong đó mct là khối lượng của chất tan được hòa tan trong nước tạo thành dung dịch bão hòa, có đơn vị là gam.
m nước là khối lượng nước, có đơn vị là gam.
Lời giải chi tiết:

CH tr 37 LT2
a) Có thể hoà tan tối đa bao nhiêu gam đường ăn trong 250 gam nước ở 30 oC?
b) Có thể hoà tan tối đa bao nhiêu gam đường ăn trong 250 gam nước ở 60 oC?
Phương pháp giải:
Dựa vào công thức tính độ tan của 1 chất ở nhiệt độ xác định
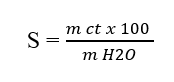
Lời giải chi tiết:
a) ở 60oC có thể hoà tan (288,8 x 250) / 100 = 722 gam đường
b) ở 30oC có thể hoà tan (216,7 x 250) / 100 = 541,75 gam đường
CH tr 38 VD1
Dung dịch D – glucose 5% được sử dụng trong y tế làm dịch truyền, nhằm cung cấp nước và năng lượng cho bệnh nhân bị suy nhược cơ thể hoặc sau phẫu thuật. Biết trong một chai dịch truyền có chứa 25 gam đường D – glucose. Tính lượng dung dịch và lượng nước có trong chai dịch truyền đó.
Phương pháp giải:
Dựa vào công thức tính
C% = (mct : m dd) x 100
Lời giải chi tiết:
Khối lượng dung dịch có trong chai truyền là:
C% = (mct : m dd) x 100
⇨ m dung dịch = (25 x 100) : 5 = 500 gam
Khối lượng nước có trong chai dịch truyền là: 500 – 25 = 475 (gam)
CH tr 38 VD2
Từ sodium chloride, nước và những dụng cụ cần thiết, nêu cách pha 500 gam dung dịch sodium chloride 0,9%.
Phương pháp giải:
Dựa vào kiến thức đã được học về pha loãng dung dịch
Lời giải chi tiết:
Tính toán trước pha chế:
Khối lượng NaCl cần dùng để pha chế là:
m NaCl = (500 x 0,9) : 100 = 4,5 (gam)
Khối lượng nước cần dùng để pha chế là:
mnước = mdung dịch - mchất tan = 500 – 4,5 = 495,5 (g)
Cách pha chế
Chuẩn bị:
- Dụng cụ: Cân điện tử, cốc thuỷ tinh (loại 1000 mL), đũa thuỷ tinh.
- Hoá chất: Muối ăn (sodium chloride), nước cất.
Tiến hành:
Bước 1: Cân chính xác 4,5 gam muối ăn cho vào cốc dung tích 1000 mL.
Bước 2: Cân lấy 495,5 gam nước cất, rồi cho dần vào cốc và khấy nhẹ cho tới khi thu được 500 gam dung dịch sodium chloride 0,9%.
CH tr 39 LT3
Tính số gam chất tan cần để pha chế 100 ml dung dịch CuSO4 0,1 M.
Phương pháp giải:
Dựa vào công thức tính nồng độ mol dung dịch: CM = n : V
Lời giải chi tiết:
Đổi 100 mL = 0,1 lít.
Số mol chất tan có trong dung dịch là:
nCuSO4 = CM × V= 0,1 × 0,1= 0,01(mol).
Khối lượng chất tan cần dùng để pha chế là:
mCuSO4=n × M = 0,01 × (64 + 32 + 16 × 4) = 1,6 (gam).
- Bài 7. Tốc độ phản ứng và chất xúc tác trang 41, 42, 43, 44, 45 Khoa học tự nhiên 8 Cánh diều
- Bài tập chủ đề 1 trang 46 Khoa học tự nhiên 8 Cánh diều
- Bài 5 Tính theo phương trình hóa học trang 32, 33, 34, 35 Khoa học tự nhiên 8 Cánh diều
- Bài 4. Mol và tỉ khối chất khí trang 27, 28, 29, 30, 31 Khoa học tự nhiên 8 Cánh diều
- Bài 3 Định luật bảo toàn khối lượng, phương trình hóa học trang 21, 22, 23, 24, 25, 26 Khoa học tự nhiên 8 Cánh diều
>> Xem thêm
Các bài khác cùng chuyên mục
- Lý thuyết Khái quát về sinh quyển và các khu sinh học - Khoa học tự nhiên 8 Cánh diều
- Lý thuyết Cân bằng tự nhiên và bảo vệ môi trường - Khoa học tự nhiên 8 Cánh diều
- Lý thuyết Hệ sinh thái - Khoa học tự nhiên 8 Cánh diều
- Lý thuyết Sự nở vì nhiệt - Khoa học tự nhiên 8 Cánh diều
- Lý thuyết Quần xã sinh vật - Khoa học tự nhiên 8 Cánh diều
- Lý thuyết Khái quát về sinh quyển và các khu sinh học - Khoa học tự nhiên 8 Cánh diều
- Lý thuyết Cân bằng tự nhiên và bảo vệ môi trường - Khoa học tự nhiên 8 Cánh diều
- Lý thuyết Hệ sinh thái - Khoa học tự nhiên 8 Cánh diều
- Lý thuyết Sự nở vì nhiệt - Khoa học tự nhiên 8 Cánh diều
- Lý thuyết Quần xã sinh vật - Khoa học tự nhiên 8 Cánh diều












Danh sách bình luận