1. Alkane là gì?
Alkane là những hydrocarbon mạch hở, phân tử chỉ chứa các liên kết đơn.
2. Tính chất vật lí
- Ở điều kiện thường: Alkane C1 – C4 và neopentane: chất khí (khí gas); C5 – C17 trừ neopentane: chất lỏng (xăng, dầu); C18 trở lên: chất rắn (nến, sáp).
- Các alkane nhẹ hơn nước, rất ít tan trong nước, tan tốt trong dung môi không phân cực do alkane kém phân cực.
- Nhiệt độ nóng chảy, nhiệt độ sôi tăng dần theo phân tử khối, alkane mạch không phân nhánh có nhiệt độ sôi cao hơn so với mạch phân nhánh.
3. Tính chất hoá học
Ở điều kiện thích hợp, alkane tham gia phản ứng thế, phản ứng cracking, phản ứng reforming và phản ứng oxi hoá.
4. Phản ứng thế halogen (Cl2, Br2/ ánh sáng hoặc t)
Tổng quát: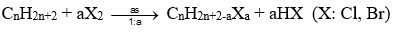
- Phản ứng trên gọi là phản ứng halogen hoá alkane, sản phẩm tạo thành gọi là dẫn xuất halogen.
- Từ C3H8 trở lên, phản ứng tạo ra nhiều sản phẩm thế và tuân theo qui tắc “Ưu tiên thế vào H của C có bậc cao hơn”.
5. Phản ứng cracking
- Cracking alkane là quá trình phân cắt liên kết C – C (bẻ gãy mạch carbon) của các alkane mạch dài để tạo thành hỗn hợp các hydrocarbon mạch ngắn hơn.
Tổng quát: 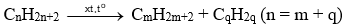
- Phản ứng cracking được ứng dụng trong công nghệ lọc dầu, giúp tạo thêm các hydrocarbon lỏng (xăng, dầu) từ alkane rắn.
6. Phản ứng refoming
- Reforming alkane là quá trình chuyển các alkane mạch không phân nhánh thành các alkane mạch phân nhánh và các hydrocarbon mạch vòng.
- Phản ứng reforming không làm thay đổi số nguyên tử carbon trong phân tử và cũng không làm thay đổi đáng kể nhiệt độ sôi của chúng.
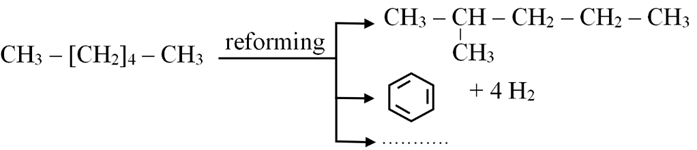
- Phản ứng reforming được dùng trong công nghiệp lọc dầu để tăng chỉ số octane của xăng.
7. Phản ứng oxi hoá
Phản ứng oxi hoá hoàn toàn (phản ứng cháy)
Tổng quát: 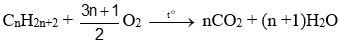
- Khi đốt cháy ankan ta luôn có: \({n_{{H_2}O}} > {n_{C{O_2}}}\)và ngược lại. \({n_{alk{\rm{a}}n{\rm{e}}}} = {n_{{H_2}O}} - {n_{C{O_2}}}\)
- Phản ứng đốt cháy alkane toả lượng nhiệt lớn để đun nấu, sưởi ấm, cung cấp năng lượng cho các ngành công nghiệp.
Phản ứng oxi hoá không hoàn toàn
- Phản ứng đốt cháy thiếu oxygen: tạo C hoặc CO.
VD: 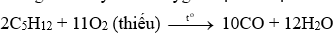
- Phản ứng oxi hoá cắt mạch tạo carboxylic acid
TQ: 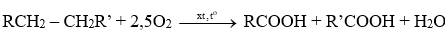
- Alkane không làm mất màu dung dịch thuốc tím KMnO4.

 Hydrocarbon - Từ điển Hoá 11
Hydrocarbon - Từ điển Hoá 11 






Danh sách bình luận