Sự điện phân là quá trình oxi hóa - khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân khi điện phân dung dịch:
*Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
+ Gốc axit có chứa oxi không bị điện phân (ví dụ: NO3-, SO42-, PO43-, CO32-, ClO4-, …). Khi đó nước bị điện phân theo bán phản ứng: 2H2O → O2 + 4H+ + 4e
+ Thứ tự anion bị điện phân: S2- > I- > Br- > Cl- > RCOO- > OH- > H2O
*Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
+ Nếu dung dịch có chứa nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
+ Một số cation không bị điện phân như K+,Na+, Ca2+, Ba2+, Mg2+, Al3+… Khi đó nước bị điện phân theo bán phản ứng: 2H2O + 2e → H2 + 2OH- 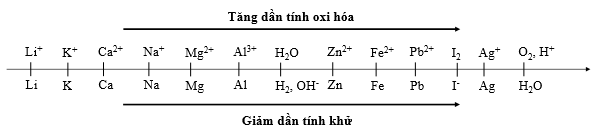
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch X chứa đồng thời AgNO3, Fe(NO3)3, Cu(NO3)2, Fe(NO3)2 bằng hệ điện phân sử dụng các điện cực than chì.
Thí nghiệm 2: Sinh viên đó tiếp tục thực hiện điện phân dung dịch CuCl2. Sau một thời gian sinh viên quan sát thấy có 6,4 gam kim loại bám vào catot. Biết nguyên tử khối của Cu và Cl lần lượt là 64 và 35,5.
Sự điện phân là quá trình oxi hóa - khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân khi điện phân dung dịch:
*Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
+ Gốc axit có chứa oxi không bị điện phân (ví dụ: NO3-, SO42-, PO43-, CO32-, ClO4-, …). Khi đó nước bị điện phân theo bán phản ứng: 2H2O → O2 + 4H+ + 4e
+ Thứ tự anion bị điện phân: S2- > I- > Br- > Cl- > RCOO- > OH- > H2O
*Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
+ Nếu dung dịch có chứa nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
+ Một số cation không bị điện phân như K+,Na+, Ca2+, Ba2+, Mg2+, Al3+… Khi đó nước bị điện phân theo bán phản ứng: 2H2O + 2e → H2 + 2OH- 
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch X chứa đồng thời AgNO3, Fe(NO3)3, Cu(NO3)2, Fe(NO3)2 bằng hệ điện phân sử dụng các điện cực than chì.
Thí nghiệm 2: Sinh viên đó tiếp tục thực hiện điện phân dung dịch CuCl2. Sau một thời gian sinh viên quan sát thấy có 6,4 gam kim loại bám vào catot. Biết nguyên tử khối của Cu và Cl lần lượt là 64 và 35,5.
Trong thí nghiệm 1, thứ tự điện phân các cation tại catot là
Trong thí nghiệm 1, thứ tự điện phân các cation tại catot là
Đáp án: B
Khi điện phân dung dịch, ở điện cực catot:
+ Nếu dung dịch có chứa nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
+ Một số cation không bị điện phân như K+,Na+, Ca2+, Ba2+, Mg2+, Al3+… Khi đó nước bị điện phân theo bán phản ứng: 2H2O + 2e → H2 + 2OH-
Khi điện phân dung dịch, tại catot thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
Dựa vào dãy điện hóa ta thấy tính oxi hóa: Ag+ > Fe3+ > Cu2+ > Fe2+
Vậy thứ tự điện phân là Ag+, Fe3+, Cu2+, Fe2+.

Trong thí nghiệm 1, giá trị pH của dung dịch thay đổi như thế nào ?
Trong thí nghiệm 1, giá trị pH của dung dịch thay đổi như thế nào ?
Đáp án: B
Viết các quá trình điện phân ở hai cực của thiết bị.
Đánh giá giá trị pH của dung dịch.
Các quá trình xảy ra trên điện cực:
+ Tại catot:
Ag+ + 1e → Ag
Fe3++ 1e → Fe2+
Cu2+ + 2e → Cu
Fe2+ + 2e → Fe
+ Tại anot: 2H2O → O2 + 4H+ + 4e
Do tại anot sinh ra ion H+ nên pH của dung dịch giảm dần.
Trong thí nghiệm 2, thể tích khí thoát ra tại điện cực anot là
Trong thí nghiệm 2, thể tích khí thoát ra tại điện cực anot là
Đáp án: B
- Từ khối lượng kim loại bám trên catot tính được số mol Cu.
- Áp dụng định luật bảo toàn electron tính được số mol Cl2.
- Tính thể tích khí thoát ra ở anot.
Các quá trình trao đổi electron:
+ Tại catot: Cu2+ + 2e → Cu
+ Tại anot: 2Cl- → Cl2 + 2e
Ta có: \({n_{Cu}} = \frac{{6,4}}{{64}} = 0,1\,\,mol\)
Áp dụng định luật bảo toàn electron: \(2{n_{Cu}} = 2{n_{C{l_2}}} \to {n_{C{l_2}}} = {n_{Cu}} = 0,1\,\,mol\)
\( \to {V_{C{l_2}}} = 0,1.22,4 = 2,24\) (lít)








Danh sách bình luận