Đề bài
Thực nghiệm cho thấy Cu tác dụng được với dung dịch FeCl3 theo phương trình hoá học: Cu + 2 FeCl3 → 2FeCl2 + CuCl2. Như vậy,
-
A.
ion Fe3+ có tính khử mạnh hơn ion Fe2+.
-
B.
ion Fe3+ có tính oxi hoá yếu hơn ion Cu2+.
-
C.
ion Fe2+ có tính oxi hoá mạnh hơn ion Fe3+.
-
D.
ion Fe3+ có tính oxi hoá mạnh hơn ion Cu2+.
Phương pháp giải
Phản ứng giữa 2 cặp oxi hóa khử xảy ra theo chiều: chất oxi hóa mạnh tác dụng với chất khử mạnh tạo thành chất oxi hóa yếu hơn và chất khử yếu hơn.
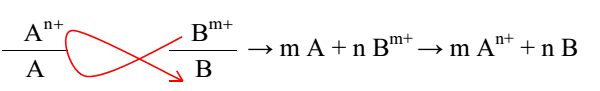
Lời giải của GV Loigiaihay.com
Dựa vào quy tắc α:
Phản ứng giữa 2 cặp oxi hóa khử xảy ra theo chiều: chất oxi hóa mạnh tác dụng với chất khử mạnh tạo thành chất oxi hóa yếu hơn và chất khử yếu hơn.
Ta có:
Cu + 2 Fe3+ → 2Fe2+ + Cu2+
C.KH mạnh C.OXH mạnh C.KH yếu C.OXH yếu
Vậy ion Fe3+ có tính oxi hoá mạnh hơn ion Cu2+
Đáp án : D








Danh sách bình luận