Al2O3 có nhiệt độ nóng chảy rất cao (2072°C) nên việc điện phân nóng chảy Al2O3 nguyên chất sẽ khó thực hiện. Hiện nay, theo công nghệ Hall-Héroult, người ta hoà tan Al2O3 trong cryolite (Na3AlF6) nóng chảy được hỗn hợp chất điện phân có nhiệt độ nóng chảy thấp hơn (khoảng gần 1000°C). Giải pháp này giúp tiết kiệm năng lượng, đồng thời tạo ra chất lỏng có tính dẫn điện tốt, nhẹ hơn Al và nổi lên phía trên lớp A1 lỏng, bảo vệ Al không bị oxi hoá bởi không khí. Sơ đồ thùng điện phân được biểu diễn như hình dưới:
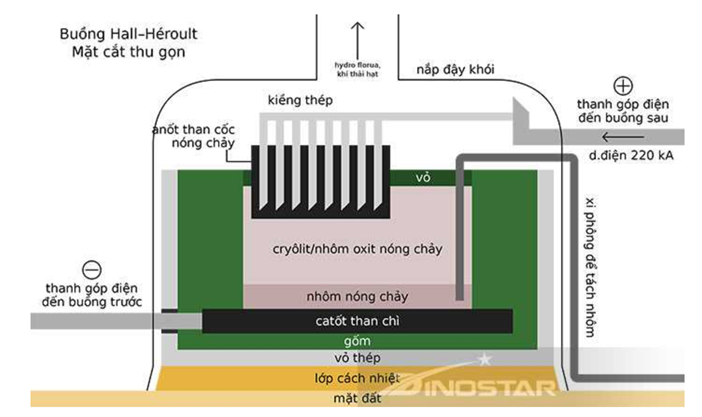
Quá trình điện phân được tiến hành với dòng điện có hiệu điện thể thấp (khoảng 5 V) và cường độ dòng điện 100 – 300 km. Để sản xuất được 1 tấn Al cần tiêu tốn khoảng 2 tấn Al2O3 50 kg cryolite, 400 kg than cốc.
Cho biết: Năng lượng điện tiêu thụ theo lí thuyết, \({A_{lt}} = \frac{{U.{m_{Al}}.F}}{{9.3,{{6.10}^6}}}\)(kWh). Với mAl là khối lượng Al được điều chế (gam); F là hằng số Faraday, F = 96485 C mol-1 , U (V) là hiệu điện thế áp đặt vào hai cực của bình điện phân.
a) Trong quá trình điện phân, điện cực dương bị hao mòn nhanh hơn điện cực âm.
b) Năng lượng điện tiêu thụ để sản xuất được 1 kg Al theo lí thuyết là 16 kWh.
c) Tại cathode xảy ra quá trình khử cation Al3+.
d) Khí thoát ra ở anode chủ yếu là khí CO2.
a) Trong quá trình điện phân, điện cực dương bị hao mòn nhanh hơn điện cực âm.
b) Năng lượng điện tiêu thụ để sản xuất được 1 kg Al theo lí thuyết là 16 kWh.
c) Tại cathode xảy ra quá trình khử cation Al3+.
d) Khí thoát ra ở anode chủ yếu là khí CO2.
Dựa vào ứng dụng của điện phân.
a. đúng
b. sai, năng lượng điện tiêu thụ để sản xuất 1 kg Al theo lí thuyết là 15 kWh.
c. đúng
d. đúng

Các bài tập cùng chuyên đề
Trong tự nhiên, các kim loại (trừ vàng, bạc và platinum) thường tồn tại dưới dạng hợp chất trong quặng. Làm thế nào để tách kim loại ra khỏi quặng?
Hãy tìm hiểu quá trình điện phân Al2O3 nóng chảy và thực hiện các yêu cầu sau:
1. Nêu vai trò của cryolite trong quá trình điện phân.
2. Tại sao sau một thời gian, cần phải thay cực dương của bình điện phân. Viết các phương trình hoá học để giải thích.
a) Hãy cho biết những kim loại nào thường được điều chế bằng phương pháp điện phân nóng chảy. Giải thích.
b) Hãy viết các quá trình xảy ra trên các điện cực và phương trình hoá học của phản ứng khi điện phân nóng chảy muối ăn.
Hãy kể tên một số kim loại được điều chế bằng phương pháp nhiệt luyện.
Quan sát Hình 20.2 và thực hiện các yêu cầu sau:
1. Cho biết điện cực nào là điện cực dương, điện cực nào là điện cực âm.
2. Hãy viết các quá trình xảy ra trên các điện cực và phương trình hoá học của phản ứng điện phân dung dịch CuSO4.
Người ta có thể thu được kim loại bằng cách tách kim loại từ hợp chất của chúng, hoặc bằng quá trình tái chế kim loại
a) Việc lựa chọn phương pháp phù hợp để tách kim loại từ hợp chất cần dựa vào cơ sở nào?
b) Vì sao cần phải tái chế kim loại?
Chỉ ra chất khử được sử dụng trong các phản ứng ở Ví dụ 1.
Chỉ ra một số đặc điểm khác nhau giữa phương pháp nhiệt luyện và phương pháp thủy luyện.
Viết phương trình hóa học của phản ứng tách nhôm từ aluminium oxide bằng phương pháp điện phân nóng chảy.
Hãy đề xuất phương pháp tách kim loại sodium từ hợp chất sodium choride. Giải thích.
Đề xuất phương pháp tách kim loại magnesium từ magnesium carbonate và viết phương trình hóa học của các phản ứng xảy ra.
Kim loại kẽm được tách từ hợp chất zinc sulfide trong khoáng vật sphalerite. Trước tiên, đốt zinc sulfide trong khí oxygen dư để tạo zinc oxide và sulfur dioxide. Để thu được zinc, có thể khử zinc oxide bằng carbon. Viết các phương trình hóa học của phản ứng xảy ra.
Sau khi khai thác quặng, cần thực hiện quá trình tách kim loại để thu được kim loại tinh khiết. Có những phương pháp nào để tách kim loại?
Xác định chất oxi hoá, chất khử trong các phản ứng ở Ví dụ 1.
Trình bày cách tách Cu từ Cu(OH)2 bằng phương pháp nhiệt luyện. Viết phương trình hoá học của các phản ứng xảy ra.
Hãy so sánh phương pháp nhiệt luyện và phương pháp thủy luyện. Phương pháp nào thường dùng trong phòng thí nghiệm để tách kim loại? Giải thích.
Có thể điện phân dung dịch muối của bạc để tách kim loại này được không? Viết phương trình hoá học của phản ứng xảy ra (nếu có).
Viết sơ đồ tách các kim loại bằng một phương pháp hoá học thích hợp từ mỗi nguyên liệu MgO và Fe2O3. Viết phương trình hoá học của các phản ứng xảy ra (nếu có).
Trình bày phương pháp hoá học thích hợp để tách kim loại bạc ra khỏi hỗn hợp kim loại bạc và đồng. Viết phương trình hoá học của các phản ứng.
Đá vôi là loại đá trầm tích bao gồm các khoáng vật calcite và các dạng kết tinh khác nhau của calcium carbonate. Đá vôi (thành phần chính CaCO3) có nhiều ứng dụng trong đời sống và sản xuất. Hãy lựa chọn và trình bày phương pháp hoá học thích hợp điều chế calcium từ CaCO3. Viết phương trình hoá học của các phản ứng.
Phương pháp thích hợp để điều chế Na từ NaCl là
-
A.
dùng potassium khử ion Mg2+ trong dung dịch.
-
B.
điện phân NaCl nóng chảy.
-
C.
điện phân dung dịch NaCl.
-
D.
nhiệt phân NaCl
Nguyên tắc tách kim loại là
-
A.
khử ion kim loại thành đơn chất.
-
B.
oxi hóa ion kim loại thành đơn chất.
-
C.
khử nguyên tử kim loại thành đơn chất.
-
D.
oxi hóa ion kim loại thành nguyên tử.
Kim loại nào sau đây được điều chế bằng phương pháp điện phân nóng chảy.
-
A.
K
-
B.
Fe
-
C.
Cu
-
D.
Ag
Dãy gồm các kim loại có thể điều chế bằng phương pháp nhiệt luyện là.
-
A.
Al, Mg, Ca
-
B.
Fe, Cr, Zn
-
C.
Ca, Na, Zn
-
D.
Mg, Ni, K.
Tiến hành các thí nghiệm sau:
(1) Cho Zn vào dung dịch AgNO3.
(2) Cho Fe vào dung dịch Fe2(SO4)3.
(3) Cho Na vào dung dịch CuSO4.
(4) Dẫn khí CO dư vào ống nghiệm có bột CuO, nung nóng.
Các thí nghiệm tạo thành đơn chất kim loại sau phản ứng là
-
A.
(3) và (4)
-
B.
(1) và (4)
-
C.
(2) và (3)
-
D.
(1) và (2)
Cho 14 g bột Fe vào 400 mL dung dịch X gồm AgNO3 0,5 M và Cu(NO3)2 x M. Khuấy nhẹ cho tới khi phản ứng kết thúc thu được dung dịch Y và 30,4 g chất rắn Z. Giá trị của x là
-
A.
0,15.
-
B.
0,125.
-
C.
0,2.
-
D.
0,1
Cho các phản ứng sau.
(1) ZnO + C → Zn + CO (2) 2Al + Cr2O3 → Al2O3 + 2Cr
(3) Cu + 2AgNO3 → Cu(NO3)2 + 2Ag (4) Fe2O3 + 3CO → 2Fe + 3CO2
(5) HgS + O2 → Hg + SO2 (6) 2Al2O3 → 4Al + 3O2
Số phản ứng điều chế kim loại bằng phương pháp nhiệt luyện là.
-
A.
6
-
B.
4
-
C.
5
-
D.
3
Cho các phát biểu sau:
(1) Các kim loại như Cu, Fe, Mg và Zn đều được điều chế bằng phương pháp nhiệt luyện.
(2) Cho Na dư vào dung dịch FeCl3, thu được dung dịch chứa hai muối.
(3) Các kim loại như Mg, Fe, Ca và Cu đều khử được ion Ag+ trong dung dịch thành Ag.
(4) Ở nhiệt độ cao, Mg khử được nước tạo thành MgO.
(5) Các kim loại như Na, Ca, Al và K đều được điều chế bằng phương pháp điện phân nóng chảy.
Số phát biểu đúng là
-
A.
2
-
B.
3
-
C.
1
-
D.
4
Cho V lít hỗn hợp khí (đkc) gồm CO và H2 phản ứng với một lượng dư hỗn hợp rắn gồm CuO và Fe3O4 nung nóng. Sau khi các phản ứng xảy ra hoàn toàn, khối lượng hỗn hợp rắn giảm 0,16 gam. Giá trị của V là
-
A.
1,2395.
-
B.
0,2479.
-
C.
0,7437.
-
D.
0,62.
Cho 1 luồng khí H2 dư lần lượt đi qua các ống mắc nối tiếp đựng các oxide nung nóng như hình vẽ sau:
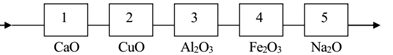
Có bao nhiêu ống xảy ra phản ứng?
-
A.
3
-
B.
2
-
C.
4
-
D.
5







Danh sách bình luận