Giả sử có sơ đồ biểu thị tiến trình thí nghiệm như sau:
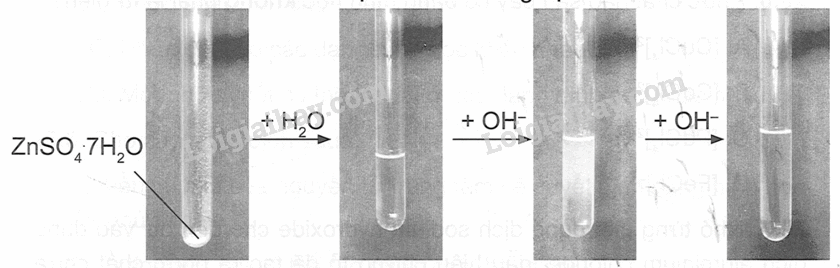
Hãy mô tả hiện tượng, mô tả sự thay thế phối tử trong phức chất. Viết phương trình hoá học của các phản ứng.
Dựa vào tính chất của phức chất.
Hiện tượng: Chất rắn màu trắng sẽ tan tạo thành dung dịch trong suốt không màu, nhỏ từng giọt dung dịch kiềm sẽ tạo thành kết tủa keo trắng. Khi cho kiềm đến dư, kết tủa sẽ tan tạo thành dung dịch trong suốt không màu.
Phối tử H2O trong phức chất aqua đã bị thay thể bởi phối tử OH- để tạo ra phức chất [Zn(OH)4]2-
Phương trình điện li trong dung dịch:
ZnSO4.7H₂O + aq→ [Zn(H2O)6]²+(aq) + H₂O(l) + SO42- (aq)
Phương trình hoá học dạng ion của phản ứng:
[Zn(H₂O)]²+(aq) + 2OH-(aq)→ [Zn(H2O)4(OH)2](s) + 2H2O(l)
Phương trình hoá học dạng ion của phản ứng khi cho dư ion OH- :
[Zn(H₂O)4(OH)2](s) + 2OH-(aq) → [Zn(OH)4]²-(aq) + 4H₂O(l)

Các bài tập cùng chuyên đề
Thí nghiệm: Sự tạo thành phức chất của Cu2+
- Chuẩn bị:
+ Hoá chất: dung dịch CuSO4 5%, dung dịch NaOH 10%, dung dịch NH3 10%, dung dịch HCl đặc.
+ Dụng cụ: ống nghiệm.
- Tiến hành.
+ Cho khoảng 1 mL dung dịch CuSO4 5% vào ống nghiệm (1). Cho tiếp 3 giọt dung dịch NaOH 10% vào ống nghiệm, lắc đều. Nhỏ từ từ dung dịch NH3 10% vào ống nghiệm, vừa nhỏ vừa lắc đều đến khi kết tủa tan hoàn toàn.
+ Cho khoảng 1 mL dung dịch CuSO4 5% vào ống nghiệm (2). Nhỏ từ từ dung dịch HCl đặc vào ống nghiệm, vừa nhỏ vừa lắc đều đến khi dung dịch chuyển màu hoàn toàn.
Quan sát hiện tượng và viết phương trình hoá học của các phản ứng xảy ra.
a) Trong dung dịch, ion Co2+ tạo thành phức chất aqua có dạng hình học bát diện. Hãy viết công thức hoá học của phức chất.
b) Khi cho một lượng dư NH3 vào dung dịch muối CoCl2, thấy màu sắc của dung dịch bị thay đổi. Hiện tượng xảy ra là do toàn bộ các phối tử H2O trong phức chất aqua bị thay thế bởi các phối tử NH3, tạo thành phức chất mới có dạng bát diện. Viết phương trình hoá học của phản ứng thế phối tử đã xảy ra.
Xét phản ứng sau:
\({{\rm{[PtC}}{{\rm{l}}_{\rm{4}}}]^{2 - }} + 2{\rm{N}}{{\rm{H}}_{\rm{3}}} \to [{\rm{PtC}}{{\rm{l}}_{\rm{2}}}{{\rm{(N}}{{\rm{H}}_{\rm{3}}}{\rm{)}}_{\rm{2}}}] + 2{\rm{C}}{{\rm{l}}^ - }\)
Hãy cho biết trong phản ứng trên có bao nhiêu phối tử \({\rm{C}}{{\rm{l}}^ - }\)trong phức chất [PtCl4]2- đã bị thế bởi phối tử NH3.
Thí nghiệm: Khả năng phản ứng của dung dịch copper(II) sulfate loãng với hydrochloric acid đặc.
- Hóa chất: Dung dịch CuSO4 0,5%, dung dịch HCl đặc.
- Dụng cụ: ống nghiệm, ống hút nhỏ giọt
Tiến hành: Thêm khoảng 2ml dung dịch HCl vào ống nghiệm chứa khoảng 1ml dung dịch CuSO4.
Yêu cầu: Quan sát và giải thích hiện tượng. Viết phương trình hóa học của phản ứng xảy ra.
Phản ứng nào dưới đây là phản ứng thay thế phối tử trong phức chất?
a) [Co(OH2)6]3+ (aq) + 6NH3 (aq) \( \to \)[Co(NH3)6]3+(aq) + 6H2O(l)
b) 2Na[Au(CN)2](aq) + Zn(s) \( \to \) Na2[Zn(CN)4](aq) + 2Au(s)
c) [Co(OH2)6]2+(aq) + 4Cl- \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)[CoCl4]2-(aq) + 6H2O(l)
Viết phương trình hoá học của phản ứng xảy ra khi hoà tan kết tủa Cu(OH)2 bằng dung dịch ammonia.
Nêu các hiện tượng quan sát được ở Thí nghiệm 2. Viết phương trình hoá học của phản ứng xảy ra trong thí nghiệm.
Cho lượng dư dung dịch NH3 tác dụng với AgCl. Phát biểu nào sau đây đúng?
-
A.
Kết tủa trắng tan dần, phức chất [Ag(NH3)2]+ không màu được tạo thành.
-
B.
Không có hiện tượng gì xảy ra.
-
C.
Kết tủa trắng tan dần, phức chất [Ag(NH3)2]+ màu xanh được tạo thành.
-
D.
Kết tủa trắng tan dần, phức chất [Ag(NH3)4]+ không màu được tạo thành.
Hai ống nghiệm (1) và (2) đều chứa phức chất của Cu2+. Ống nghiệm (1) có màu xanh lam, ống nghiệm (2) có màu xanh nhạt, ống nghiệm (1) và (2) lần lượt chứa phức chất là
-
A.
[Cu(H2O)6]2+ và [Cu(NH3)4(H2O)2]
-
B.
[Cu(H2O)6]2+ và [CuCl4]2.
-
C.
[CuCl4]2- và [Cu(NH3)4(H2O)2].
-
D.
[Cu(NH3)4(H2O)2] và [Cu(H2O)6]2+
Phản ứng nào dưới đây không phải là phản ứng thay thế phối tử trong phức chất?
-
A.
[Co(OH2)6]3+(aq) + 6NH3(aq) ⟶ [Co(NH3)6]3+(aq) + 6H2O(l)
-
B.
2Na[Au(CN)2](aq) + Zn(s) ⟶ Na2[Zn(CN)4](aq) + 2Au(s)
-
C.
[Co(OH2)6]2+(aq) + 4Cl−(aq) ⇌ [CoCl4]2−(aq) + 6H2O(l)
-
D.
[Ni(OH2)6]2+(aq) + 6NH3(aq) → [Ni(NH3)6]2+(aq) + 6H2O (l)
Trong kĩ thuật tráng phim đen trắng, người ta dùng dung dịch Na2S2O3 (sodium thiosulfate) để loại bỏ AgBr còn dư trên phim. Tính độ tan (mol/L) của AgBr trong nước và trong dung dịch Na2S2O3 0,1 M để chứng minh kĩ thuật đó là có cơ sở khoa học.
Cho biết: AgBr(s) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)Ag+(aq) + Br-(aq) K1 = 5x10-13
Ag+(aq) + 2S2O32-(aq) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) [Ag(S2O3)2]3-(aq) K2 = 4x1013
Dự đoán hiện tượng xảy ra, mô tả sự thay thế phối tử khi cho từ từ đến dư dung dịch ammonia vào dung dịch muối nickel(II) chloride. Viết phương trình hoá học của các phản ứng.
Cho cân bằng sau:
[CoCl4]²-(aq) + 6H₂O(1) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)[Co(H₂O)6]2+(aq) +4Cl-(aq) \({\Delta _r}H_{298}^0 < 0\)
(màu xanh chàm)(màu đỏ hồng)
a) Màu của dung dịch sẽ thay đối như thể nào khi đun nóng?
b) Khi thêm dung dịch HCl, dung dịch sẽ có màu gì?
c) Hãy cho biết dạng hình học của các phức chất trong cân bằng trên.
Nhỏ từng giọt dung dịch sodium hydroxide cho đến dư vào dung dịch aluminium chloride, dấu hiệu chứng tỏ đã tạo ra phức chất chứa phối từ OH- là
A. kết tủa bị hoà tan.
B. dung dịch bị chuyên từ không màu sang có màu.
C. kết tủa keo trắng tạo thành.
D. dung dịch bị mất màu.
Trong dung dịch, ion Fe3+ tồn tại dưới dạng phức chất aqua có sáu phối tử nước.
a) Phức chất aqua có công thức hoá học là [Fe(H2O)6]3+.
b) Phức chất aqua có dạng hình học vuông phẳng.
c) 6 phối tử nước đã cho cặp electron chưa liên kết vào ion Fe3+.
d) Nguyên tử trung tâm trong phức chất aqua là Fe2+.
Xét phản ứng sau: [Cu(H2O)6]2+ + NH3 → [Cu(NH3)(H2O)5]2+
a) Phản ứng thuộc loại phản ứng oxi hoá - khử.
b) 1 phối tử nước trong phức chất [Cu(H2O)6]2+ đã bị thế bởi 1 phối tử NH3.
c) Dấu hiệu của phức chất [Cu(NH3)(H2O)5]2+ tạo thành là tạo thành kết tủa.
d) Phức chất tạo thành có tổng 6 phối tử.
Có 4 lọ hóa chất mất nhãn, mỗi lọ đựng dung dịch của một trong các phức chất sau: [Ag(NH3)2]+, [CuCl4]2-, [Fe(H2O)6]2+, [Cu(NH3)4(H2O)2]2+.
a) Lọ không có màu đựng phức chất [Ag(NH3)2]+ .
b) Lọ có màu da cam đựng phức chất [Fe(H2O)6]2+.
c) Lọ có màu xanh lam đựng phức chất [Cu(NH3)4(H2O)2]2+.
d) Lọ có màu xanh nhạt đựng phức chất [CuCl4]2-.
Thực hiện haỉ thí nghiệm liên tiếp: (1) nhỏ từ từ dung dịch NaCl vào ống nghiệm đựng dung dịch AgNO3; (2) sau đó nhỏ thêm dung dịch NH3 đến dư vào ống nghiêm.
a) Phức chất AgCl kết tủa trắng được tạo thành ở thí nghiệm (1).
b) Phức chất [Ag(NH3)2]+ không màu được tạo thành ở thí nghiệm (2).
c) Dấu hiệu nhận biết phức chất [Ag(NH3)2]+ tạo thành là kết tủa tan.
d) Phức chất được tạo thành ở thí nghiệm (2) chứa bốn phối tử NH3.
Cho CuSO4 khan không màu vào nước được dung dịch phức chất A màu xanh. Nhỏ từ từ dung dịch NH3 đặc vào dung dịch A, lúc đầu thấy xuất hiện kết tủa phức chất B màu xanh nhạt, sau đó kết tủa tan dần tạo thành dung dịch phức chất C màu xanh lam.
a) Phức chất A là [Cu(H2O)6]2+.
b) Phức chất B là [Cu(NH3)4(H2O)2]2+.
c) Phức chất C là [Cu(OH)2(H2O)4].
d) Dấu hiệu nhận biết sự tạo thành phức chất C là: hoà tan kết tủa và đổi màu dung dịch.
Hãy chọn đủng hoặc sai cho mỗi ý a, b, c, d ở các câu 23, 24, 25, 26, 27, 28, 29.
Phức chất [Cu(H2O)6]2+, [Cu(NH3)4(H2O)2] và [Co(H2O)6]2+ có màu xanh, xanh lam và hồng đỏ.
a) Các phức chất có cùng nguyên tử trung tâm có màu sắc giống nhau.
b) Các phức chất có cùng phối tử có màu sắc giống nhau.
c) Màu sắc của phức chất không phụ thuộc vào bản chất của nguyên tử trung tâm và phối tử.
d) Màu sắc của phức chất phụ thuộc vào bản chất của nguyên tử trung tâm và phối tử.
Trong phức chất [Co(H2O)6]2+, 2 phối tử H2O có thể bị thế bởi 2 phối tử OH-. Phát biểu nào sau đây không đúng?
A. Phức chất tạo thành có 4 phối tử nước và 2 phối tử OH-.
B. Phức chất tạo thành có điện tích +2.
C. Phức chất tạo thành có nguyên tử trung tâm là Co2+.
D. Phức chất tạo thành là [Co(OH)2(H2O)4].
Phối tử H2O trong phức chất aqua [Cu(H2O)6]2+ có thể bị thế bởi 1 phối tử NH3 tạo thành phức chất là
A. [Cu(NH3)6]2+. B. [Cu(NH3)2(H2O)5].
C. [Cu(NH3)(H2O)5]2+. D. [Cu(NH3)(H2O)5].
Các phối tử H2O trong phức chất [Ni(H2O)6]2+ có thể bị thế hết bởi sáu phối tử NH3 tạo thành phức chất là
A. [Ni(NH3)6]2+. B. [Ni(NH3)2(H2O)4].
C. [Ni(NH3)(H2O)5]2+. D. [Ni(NH3)5(H2O)]2+.
Phát biểu nào sau đây không đúng?
A. Trong dung dịch, các ion kim loại chuyển tiếp đều tạo phức chất aqua.
B. Các phối tử H2O trong phức chất aqua không thể bị thế bởi các phối tử khác.
C. Phức chất aqua của các ion kim loại chuyển tiếp hầu hết có dạng hình học bát diện.
D. Các phối tử trong phức chất có thể bị thay thế một phần hoặc thay thế hết bởi các phối tử khác.
Phát biểu nào sau đây đúng?
A. Phức chất aqua là phức chất chứa phối tử NH3.
B. Phức chất của kim loại chuyển tiếp đều tan trong dung dịch.
C. Muối CuSO4 khan màu trắng khi tan vào nước tạo thành dung dịch có màu xanh do tạo thành phức chất aqua [Cu(H2O)612+.
D. Phức chất của kim loại chuyển tiếp đều có màu.
Nhỏ vài giọt dung dịch NaOH loãng vào dung dịch CuSO4 tạo thành phức chất
[Cu(OH)2(H2O)4]. Dấu hiệu nào sau đây chứng tỏ phức chất [Cu(OH)2(H2O)4] tạo thành?
A. Xuất hiện kết tủa màu xanh lam.
B. Hoà tan kết tủa.
C. Dung dịch chuyển từ màu xanh sang màu vàng.
D. Xuất hiện kết tủa màu xanh nhạt.
Cho lượng dư dung dịch NH3 tác dụng với AgCl. Phát biểu nào sau đây đúng?
A. Kết tủa trắng tan dần, phức chất [Ag(NH3)2]+ không màu được tạo thành.
B. Không có hiện tượng gì xảy ra.
C. Kết tủa trắng tan dần, phức chất [Ag(NH3)2]+ màu xanh được tạo thành.
D. Kết tủa trắng tan dần, phức chất [Ag(NH3)4]+ không màu được tạo thành.
Nhỏ vài giọt dung dịch HCl đặc vào dung dịch CuSO4 tạo thành phức chất [CuCl4]2-. Dấu hiệu nào sau đây chứng tỏ phức chất [CuCl4]2- tạo thành?
A. Hoà tan kết tủa.
B. Đổi màu dung dịch từ màu xanh sang màu vàng.
C. Xuất hiện kết tủa.
D. Đổi màu dung dịch từ màu xanh lam sang màu vàng.
Hai ống nghiệm (1) và (2) đều chứa phức chất của Cu2+. Ống nghiệm (1) có màu xanh lam, ống nghiệm (2) có màu xanh nhạt, ống nghiệm (1) và (2) lần lượt chứa phức chất là
A. [Cu(H2O)6]2+ và [Cu(NH3)4(H2O)2]
B. [Cu(H2O)6]2+ và [CuCl4]2.
C. [CuCl4]2- và [Cu(NH3)4(H2O)2].
D. [Cu(NH3)4(H2O)2] và [Cu(H2O)6]2+
Khi hòa tan zinc(II)chloride trong nước, diễn ra một số quá trình cơ bản sau:
Zn2+(aq) + 6H2O(l) → [Zn(OH2)6]2+(aq) (I)
[Zn(OH2)6]2+(aq)→ [Zn(OH)(OH2)5]+(aq) + H+(aq) KC=10-9 (II)
H+(aq) + H2O(l) → H3O+(aq) (III)
Cho các phát biểu sau:
(1) Quá trình (I) và (III) có thể diễn ra yếu hơn quá trình (II).
(2) Từ quá trình (II) có thể suy ra “[Zn(OH2)6]2+ là acid theo Arrhenius”.
(3) Từ quá trình (III) có thể suy ra “H2O là base theo Bronsted - Lowry”.
(4) Từ quá trình (I), (II) và (III) suy ra “trong nước, cation Zn2+ là acid theo Bronsted - Lowry”.
(5) Dung dịch zinc(II) chloride có tính acid khá mạnh.
(6) Trong dung dịch zinc(II) chloride, nước vừa là dung môi, vừa đóng vai trò base theo Bronsted - Lowry.
Số phát biểu đúng là:
A. 2. B. 3. C. 4. D 5







Danh sách bình luận