Cho các khí hiếm sau: He (Z = 2), Ne (Z = 10), Ar (Z = 18), Kr (Z = 36), Xe (Z = 54). Khí hiếm nào có nhiệt độ nóng chảy cao nhất. Giải thích.
Cho các khí hiếm sau: He (Z = 2), Ne (Z = 10), Ar (Z = 18), Kr (Z = 36), Xe (Z = 54). Khí hiếm nào có nhiệt độ nóng chảy cao nhất. Giải thích.
Dựa vào tương tác van der waals
Theo chiều tăng dần của điện tích hạt nhân nguyên tử trong nhóm VIIIA (nhóm khí hiếm), bán kính nguyên tử tăng đồng thời khối lượng nguyên tử tăng.
⇒ Tương tác van der Waals tăng ⇒ Nhiệt độ nóng chảy tăng.
⇒ Khí hiếm có nhiệt độ nóng chảy cao nhất trong dãy là Xe.

Các bài tập cùng chuyên đề
Hãy giải thích sự khác nhau về nhiệt độ sôi của butane và isobutane
Giải thích vì sao con tắc kè có thể di chuyển trên mặt kính trơn nhẵn, thẳng đứng.

Sưu tầm hình ảnh tinh thể nước đá, bông tuyết.
Thu nhập thông tin liên quan đến các hiện tượng có xuất hiện của liên kết hydrogen, tương tác van der Waals trong thực tiễn.
Chọn phương án đúng
1. Những phát biểu nào sau đây là đúng khi nói về các loại liên kết?
a) Liên kết hydrogen yếu hơn liên kết ion và liên kết cộng hóa trị.
b) Liên kết hydrogen mạnh hơn liên kết ion và liên kết cộng hóa trị.
c) Tương tác van der Waals yếu hơn liên kết hydrogen.
d) Tương tác van der Waals mạnh hơn liên kết hydrogen.
2. Các liên kết biểu diễn bằng các đường nét đứt có vai trò quan trọng trong việc làm bền chuỗi xoắn đôi DNA. Đó là loại liên kết gì?
A. Liên kết ion.
B. Liên kết cộng hóa trị có cực.
C. Liên kết cộng hóa trị không cực.
D. Liên kết hydrogen.

Quan sát Hình 11.7, cho biết thế nào là một lưỡng cực tạm thời?
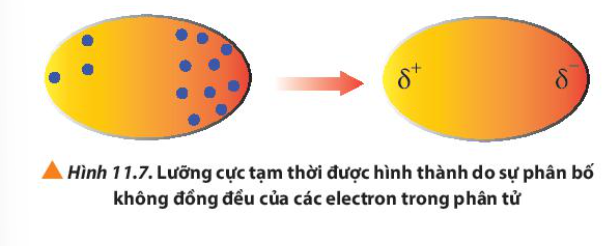
Các lưỡng cực tạm thời và lưỡng cực cảm ứng hút nhau bằng lực hút nào?
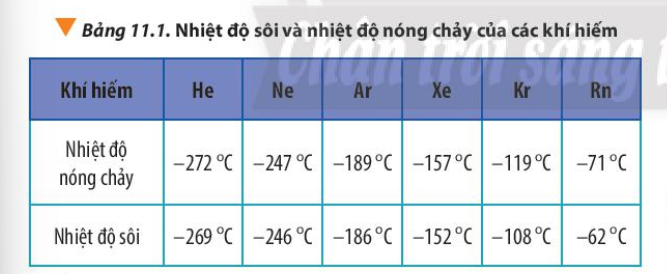
Giải thích xu hướng biến đổi bán kính nguyên tử, nhiệt độ nóng chảy và nhiệt độ sôi của các nguyên tố khí hiếm trong Bảng 11.1
Sự phân bố electron không đồng đều trong một nguyên tử hay một phân tử hình thành nên
A. một ion dương
B. một ion âm
C. một lưỡng cực vĩnh viễn
D. một lưỡng cực tạm thời
Khí hiếm nào dưới đây có nhiệt độ sôi thấp nhất?
A. Ne
B. Xe
C. Ar
D. Kr
Giải thích vì sao tetrachloromethane (CCl4) tuy là phân tử không cực nhưng có nhiệt độ sôi cao hơn trichloromethane (CHCl3) là phân tử có cực.
So sánh nhiệt độ nóng chảy và nhiệt độ sôi của pentane (CH3CH2CH2CH2CH3) và neopentane ((CH3)4C). Giải thích nguyên nhân sự khác biệt trên.
Nhiệt độ sôi của các hợp chất với hydrogen của các nguyên tố nhóm VA, VIA và VIIA được biểu diễn qua đồ thị sau:
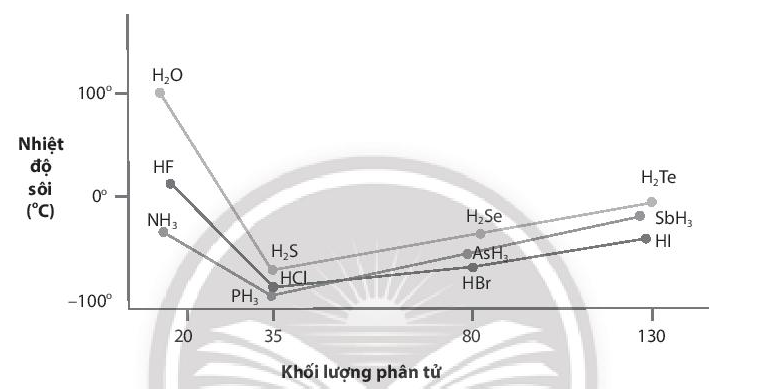
a) Giải thích nhiệt độ sôi cao bất thường của các hợp chất với hydrogen của các nguyên tố đầu tiên trong mỗi nhóm.
b) Nhận xét nhiệt độ sôi của các hợp chất với hydrogen của các nguyên tố còn lại ở mỗi nhóm và giải thích nguyên nhân sự biến đổi nhiệt độ sôi của chúng.
Giải thích tại sao ở điều kiện thường, các nguyên tố trong nhóm halogen như fluorine và chlorine ở trạng thái khí, còn bromine ở trạng thái lỏng và iodine ở trạng thái rắn.
Giải thích vì sao các tương tác van der Waals giữa các phân tử có kích thước lớn lại mạnh hơn so với các phân tử có kích thước nhỏ.
Thiết bị chụp cộng hưởng từ hạt nhân (NMR) sử dụng nitrogen lỏng để làm mắt nam châm siêu dẫn. Nitrogen lỏng sôi ở -195,8°C. Dự đoán nhiệt độ sôi của oxygen lỏng sẽ cao hay thấp hơn so với nitrogen lỏng? Giải thích.
Hãy so sánh tương tác van der Waals với liên kết ion.
Trong các khí hiếm sau, khí hiếm có nhiệt độ sôi cao nhất là
A. Ne.
B. Xe.
C. Ar.
D. Kr.
Tương tác van der Waals xuất hiện là do sự hình thành các lưỡng cực tạm thời cũng như các lưỡng cực cảm ứng. Các lưỡng cực tạm thời xuất hiện là do sự chuyển động của
A. các nguyên tử trong phân tử.
B. các electron trong phân tử.
C. các proton trong hạt nhân.
D. các neutron và proton trong hạt nhân
Dầu mỏ chứa hỗn hợp nhiều hydrocarbon như: octane (C8H18) có trong xăng, butane (C4H10) có trong gas. Khi chưng cất dầu mỏ, octane hay butane sẽ bay hơi trước? Giải thích.
Nhiệt độ sôi của từng chất methane, ethane, propane và butane là một trong bốn nhiệt độ sau: 0 °C; -164 °C; -42 °C và -88 °C. Nhiệt độ sôi -88 °C là của chất nào sau đây
A. methane.
B. propane.
C. ethane.
D. butane.
Cho các khí hiểm sau: He, Ne, Ar, Kr, Xe. Khí hiếm có nhiệt độ nóng chảy thấp nhất và cao nhất lần lượt là
A. Xe và He.
B. Ar và Ne.
C. He và Xe.
D. He vȧ Kr.
Dãy chất nào sau đây xếp theo thứ tự nhiệt độ sôi tăng dần?
A. H2O, H2S, CH4.
B. H2S, CH4, H2O.
C. CH4, H2O, H2S.
D. CH4, H2S, H2O.
Cho các chất sau F2, Cl2, Br2, I2. Chất có nhiệt độ sôi cao nhất là
A. F2. B. Cl2. C. Br2. D. I2.
Cho các chất sau: F2, Cl2, Br2, I2. Chất có nhiệt độ nóng chảy thấp nhất là
A. F2. B. Cl2. C. Br2. D. I2.
Tương tác van der Waals tồn tại giữa những
A. ion. B. hạt proton. C. hạt neutron. D. phân tử.
Tương tác van der Waals được hình thành do
A. tương tác tĩnh điện lưỡng cực - lưỡng cực giữa các nguyên tử.
B. tương tác tĩnh điện lưỡng cực - lưỡng cực giữa các phân tử.
C. tương tác tĩnh điện lưỡng cực - lưỡng cực giữa các nguyên tử hay phân tử.
D. lực hút tĩnh điện giữa các phân tử phân cực.
Nhiệt độ sôi của ba hợp chất được cho trong bảng sau:
|
Hợp chất |
Khối lượng phân tử (g mol-1) |
Nhiệt độ sôi (toC) |
|
2 – hexanone |
100,16 |
128,0 |
|
heptane |
100,20 |
98,0 |
|
1 – hexanol |
102,17 |
156,0 |
Không cần tra cứu cấu trúc, em hãy trả lời các câu hỏi sau về ba hợp chất này:
a) Hợp chất nào có thể hình thành liên kết hydrogen?
b) Hợp chất nào phân cực nhưng không hình thành liên kết hydrogen?
c) Hợp chất nào ít phân cực, không hình thành liên kết hydrogen?
Hãy giải thích sự biến đổi về nhiệt độ nóng chảy của dãy hydrogen halide sau:
|
Halogen halide |
HF |
HCl |
HBr |
HI |
|
Nhiệt độ nóng chảy (oC) |
-83,1 |
-114,8 |
-88,5 |
-50,8 |
Ở điều kiện thường, các khí hiếm tồn tại ở dạng khí đơn nguyên tử. Hãy giải thích sự biến đổi nhiệt độ sôi của các khí hiếm từ He tới Rn theo số liệu trong bảng sau:
|
Khí hiếm |
He |
Ne |
Ar |
Kr |
Xn |
Rn |
|
Số hiệu nguyên tử |
2 |
10 |
18 |
36 |
54 |
86 |
|
Nhiệt độ sôi (°C) |
-269 |
-246 |
-186 |
-152 |
-108 |
-62 |
Hãy giải thích lí do khác nhau về nhiệt độ sôi của các cặp chất có cùng số electron sau đây: CH3 – CH3 (184,5 K) và CH3 – F (194,7 K).






