Hợp kim cobalt được sử dụng rộng rãi trong các động cơ máy bay vì độ bền nhiệt độ cao là một yếu tố quan trọng. Nguyên tử cobalt có cấu hình thu gọn ở trạng thái cơ bản là [Ar]3d74s2. Số thứ tự cobalt trong bảng tuần hoàn là
-
A.
25.
-
B.
24.
-
C.
27.
-
D.
29.
Dựa vào cấu hình của Co.
Cấu hình của Co là : [Ar]3d74s2.
Số hiệu nguyên tử : 18 + 7 + 2 = 27.
Đáp án C
Đáp án : C

Các bài tập cùng chuyên đề
Một loại hợp kim nhẹ, bền được sử dụng rộng rãi trong kĩ thuật hàng không chứa hai nguyên tố A, B đứng kế tiếp nhau trong cùng một chu kì của bảng tuần hoàn và có tổng số đơn vị điện tích hạt nhân là 25.
a) Viết cấu hình electron, từ đó xác định vị trí của hai nguyên tố A và B trong bảng tuần hoàn.
b) So sánh tính chất hóa học của A với B và giải thích.
Cấu hình electron của:
- Nguyên tử X: 1s22s22p63s23p64s1
- Nguyên tử Y: 1s22s22p63s23p4
a) Mỗi nguyên tử X và Y chứa bao nhiêu electron?
b) Hãy cho biết số hiệu nguyên tử của X và Y.
c) Lớp electron nào trong nguyên tử X và Y có mức năng lượng cao nhất?
d) Mỗi nguyên tử X và Y có bao nhiêu lớp electron, bao nhiêu phân lớp electron?
e) X và Y là nguyên tố kim loại, phi kim hay khí hiếm?
Dự đoán tính chất hóa học cơ bản (tính kim loại, tính phi kim) của các nguyên tố có Z từ 1 đến 20.
Quan sát Bảng 4.2, hãy cho biết dựa trên cơ sở nào để dự đoán phosphorus là nguyên tố phi kim
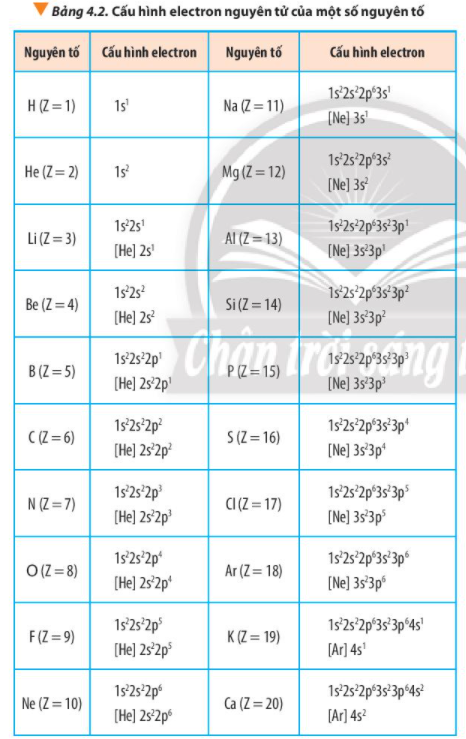
Viết cấu hình electron nguyên tử của các nguyên tố: carbon (Z = 6), sodium (Z = 11) và oxygen (Z = 8). Cho biết số electron lớp ngoài cùng trong nguyên tử của các nguyên tố trên. Chúng là kim loại, phi kim hay khí hiếm
Hợp chất A có công thức M4X3. Tổng số hạt proton, electron và neutron trong phân tử A là 214. Tổng số hạt proton, neutron, electron của (M)4 nhiều hơn so với (X)3 trong A là 106.
a) Xác định công thức hoá học của A.
b) Viết cấu hình electron của các nguyên tử tạo nên A.
Viết cấu hình electron theo ô orbital của nguyên tử các nguyên tố có Z = 9, Z = 14 và Z = 21. Chúng là nguyên tố kim loại, phi kim hay khí hiếm?
Nguyên tố X có Z = 12 và nguyên tố Y có Z = 17. Viết cấu hình electron nguyên tử của nguyên tố X và Y. Khi nguyên tử của nguyên tố X nhường đi hai electron và nguyên tử của nguyên tố Y nhận thêm một electron thì lớp electron ngoài cùng của chúng có đặc điểm gì?
Trong tự nhiên, hợp chất X tồn tại ở dạng quặng có công thức ABY2. X được khai thác và sử dụng nhiều trong luyện kim hoặc sản xuất acid. Trong phân tử X, nguyên tử của hai nguyên tố A và B đều có phân lớp ngoài cùng là 4s, các ion A2+, B2+ có số electron lớp ngoài cùng lần lượt là 17 và 14. Tổng số proton trong X là 87.
a) Viết cấu hình electron nguyên tử của A và B.
b) Xác định X.
Nguyên tử nguyên tố X có tổng số hạt cơ bản là 82. Số hạt mang điện nhiều hơn số hạt không mang điện là 22.
a) Viết kí hiệu nguyên tử của nguyên tố X.
b) Xác định số lượng các hạt cơ bản trong ion X2+ và viết cấu hình electron của ion đó.
Nguyên tố X được sử dụng rộng rãi trong đời sống: đúc tiền, làm đồ trang sức, làm răng giả,... Muối iodide của X được sử dụng nhằm tụ mây tạo ra mưa nhân tạo. Tổng số hạt cơ bản trong nguyên tử nguyên tố X là 155, số hạt mang điện nhiều hơn số hạt không mang điện là 33 hạt. Xác định nguyên tố X.
Cho các nguyên tố có điện tích hạt nhân như sau Z = 9; Z = 16, Z = 18, Z = 20 và Z = 29 Các nguyên tố trên là kim loại, phi kim hay khi hiếm?
Ion nào sau đây không có cấu hình electron của khí hiếm?
A. Na+.
B. Al3+
C. Cl-.
D. Fe2+.
Nguyên tố A có cấu hình electron lớp ngoài cùng là 4s1. Nguyên tố B có phân lớp cuối là 3p5. Viết cấu hình electron đầy đủ của A, B. Xác định tên A, B.
A được dùng để chế tạo đèn có cường độ sáng cao. Nguyên tử A có electron ở phân lớp 3d chỉ bằng một nửa phân lớp 4s. Viết cấu hình electron của nguyên tử A và tên nguyên tố A.
X được dùng để làm vỏ phủ vệ tinh nhân tạo hay khí cầu nhằm tăng nhiệt độ nhờ có tính hấp thụ bức xạ điện từ mặt trời khá tốt. Y là một trong những thành phần đề điều chế nước Javen tẩy trắng quần áo, vải sợi. Nguyên tử của nguyên tố X có tổng số hạt electron trong các phân lớp p là 7. Số hạt mang điện của một nguyên tử Y nhiều hơn số hạt mang điện của một nguyên tử X là 8 hạt. Tìm các nguyên tố X và Y.
X được dùng làm chất bán dẫn trong kĩ thuật vô tuyến điện, chế tạo pin mặt trời. Nguyên tử của nguyên tố X có 3 lớp electron. Lớp ngoài cùng có 4 electron. Xác định số hiệu nguyên tử của X và tên nguyên tố X. Viết cấu hình electron của X.
Nguyên tố X được sử dụng rộng rãi để chống đóng băng và khử băng như một chất bảo quản. Nguyên tố Y là nguyên tố thiết yếu cho các cơ thể sống, đồng thời nó được sử dụng nhiều trong việc sản xuất phân bón. Nguyên tử của nguyên tố X có electron ở mức năng lượng cao nhất là 3p. Nguyên tử của nguyên tố Y có một electron ở lớp ngoài cùng 4s. Nguyên tử X và Y có số electron hơn kém nhau là 3. Nguyên tử X, Y lần lượt là
A. khí hiếm và kim loại.
B. kim loại và khí hiếm.
C. kim loại và kim loại.
D. phi kim và kim loại.
Viết cấu hình electron dưới dạng ô lượng tử của các nguyên tử 12Mg và 24Cr. Hãy cho biết các nguyên tố này là kim loại, phi kim hay khí hiếm.
Cấu hình electron của nguyên tử nguyên tố X có dạng 1s22s22p63s23p3. Phát biểu nào sau đây là sai?
A. X ở ô số 15 trong bảng tuần hoàn.
B. X là một phi kim.
C. Nguyên tử của nguyên tố X có 9 electron p.
D. Nguyên tử của nguyên tố X có 3 phân lớp electron.
Bromine (Z = 35) dễ phản ứng, trong khi krypton (Z = 36) tương đối trơ về mặt hóa học. Giải thích sự khác biệt này dựa trên cấu hình electron của chúng.
Từ các nguyên tử có thể tạo ra các ion bằng cách thêm hoặc bớt electron từ nguyên tử đó.
a) Oxygen là nguyên tố chiếm tỉ lệ phần trăm khối lượng cao nhất trong cơ thể con người (khoảng 65%). Hãy viết cấu hình electron của O và O2- (Z = 8). Cho biết để hình thành ion O2-, nguyên tử O sẽ nhận thêm electron vào orbital nào. Xác định số electron độc thân trong nguyên tử và ion này.
b) Nhôm (aluminium) được sử dụng phổ biến trong đời sống (chế tạo dụng cụ nhà bếp, cửa, …) cũng như công nghiệp (chế tạo một số bộ phận của máy bay). Hãy biểu diễn cấu hình electron của Al và ion Al3+ (Z = 13) dưới dạng ô orbital. Cho biết để tạo thành ion Al3+, nguyên tử Al sẽ mất đi electron từ orbital nào. Xác định số electron độc thân trong các nguyên tử và ion này.
Cho các cấu hình electron của một số nguyên tử nguyên tố như sau:
(1) 1s22s22p6
(2) 1s22s22p63s2
(3) 1s22s22p63s23p63d64s2
(4) 1s22s22p63s23p63d14s2
(5) 1s22s22p63s23p4
(6) 1s22s22p63s23p5
Số lượng các nguyên tố kim loại trong số các nguyên tố ở trên là
A. 1. B. 2. C. 3. D. 4.
Nối mỗi cấu hình electron của nguyên tử ở cột A với các loại nguyên tố hóa học thích hợp ở cột B.
X là nguyên tố rất cần thiết cho sự chuyển hóa của calcium, phosphorus, sodium, potassium, vitamin C và các vitamin nhóm B. Ở trạng thái cơ bản, cấu hình electron lớp ngoài cùng của nguyên tử X là 3s2. Số hiệu nguyên tử của nguyên tố X là
A. 12.
B. 13.
C. 11.
D. 14.
Các muối của nguyên tố chromium được dùng trong ngành thuộc da, làm phụ gia cho xăng, chất nhuộm màu xanh lục hay màu hồng ngọc cho đồ gốm, trang thiết bị trong dàn khoan, thuốc nhuộm, sơn và chất vệ sinh cho đồ dùng thuỷ tinh trong phòng thí nghiệm. Nguyên tử nguyên tố Cr có cấu hình 1s22s22p63s23p63d54s1. Vị trí của nguyên tố Cr trong bảng tuần hoàn:
A. ô 24, chu kì 3, nhóm IA.
B. ô 24, chu kì 4, nhóm VIB.
C. ô 24, chu kì 4, nhóm VIA.
D. ô 24, chu kì 4, nhóm IB.
Nguyên tố X thuộc nhóm IA, còn nguyên tố Z thuộc nhóm VIIA của bảng tuần hoàn. Cấu hình electron hoá trị của nguyên tử các nguyên tố X, Z lần lượt là
A. ns1 và ns2np5.
B. ns1 và ns2np7.
C. ns1 và ns2np3.
D. ns2 và ns2np5.







