Cho m gam bột Fe vào dung dịch HNO3 lấy dư, ta được hỗn hợp gồm hai khí NO2 và NO có VX = 9,916 lít (đkc) và tỉ khối đối với O2 bằng 1,3125. Khối lượng của Fe đã dùng là bao nhiêu ? (Fe = 56, N = 14, O =16)
Dựa vào tính chất hóa học của nitric acid.
MX = 1,3125.32 = 42
n X = 9,916 : 24,79 = 0,4 mol
Gọi số mol NO2 và NO lần lượt là a và b mol
Ta có: \(\left\{ \begin{array}{l}a + b = 0,4\\46{\rm{a}} + 30b = 42.0,4\end{array} \right. \to \left\{ \begin{array}{l}a = 0,3\\b = 0,1\end{array} \right.\)
Bảo toàn electron ta có:
Fe0 \( \to \)Fe+3 + 3e N+5 +1e\( \to \)N+4
N+5 + 3e\( \to \)N+2
Áp dụng ĐLBTe \( \to \) nFe.3 = 1.nNO2 + 3.nNO \( \to \) nFe = 0,2 mol \( \to \) mFe = 11,2 gam.

Các bài tập cùng chuyên đề
Năm 1872, trong cuốn sách Không khí và Mưa, Robert Angus Smith (Rô-bớt An-gớt Smit) (nhà hoá học người Scotland) đã trình bày chi tiết về hiện tượng mưa acid. Đến cuối những năm 1960, mưa acid đã thực sự ảnh hưởng đến môi trường các vùng rộng lớn ở Tây Âu và Đông Bắc Mỹ. Ngày nay, mưa acid trở thành một trong các thảm hoạ môi trường toàn cầu. Vậy mưa acid là gì? Hợp chất của nitrogen với oxygen có vai trò gì trong hiện tượng đó?
Từ đặc điểm cấu tạo, dự đoán tính tan và tính chất hóa học của nitric acid.
Viết phương trình phân li và các phương trình hóa học minh họa cho tính chất acid mạnh của nitric acid.
Quan sát Hình 5.2, mô tả quá trình hình thành mưa acid.
Viết các phương trình hoá học của chuỗi phản ứng tạo ra nitric acid từ nitrogen trong không khí
N2→ NO→NO2→HNO3
Quan sát Hình 5.3, hãy nêu một số tác hại của mưa acid.
Quan sát Hình 5.4a, cho biết các liên kết hoá học giữa các nguyên tử trong phân tử HNO3 thuộc loại liên kết gì. Xác định số oxi hoá của nitrogen trong HNO3. Dự đoán vai trò của HNO3 trong các phản ứng oxi hoá — khử.
Tại sao phải bảo quản nitric acid trong lọ tối màu?
Hãy tìm hiểu và cho biết HNO3 được ứng dụng vào những lĩnh vực nào trong đời sống và sản xuất.
Tại sao phải bảo quản nitric acid trong lọ tối màu?
Viết phương trình hoá học của các phản ứng khi cho dung dịch HNO3 tác dụng với CuO, Ca(OH)2, CaCO3. Các phản ứng này có phải phản ứng oxi hoá — khử không? Giải thích.
Trong công nghiệp, người ta sản xuất nitric acid (HNO3) từ ammonia theo sơ đồ chuyển hoá sau:
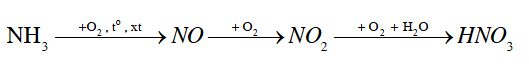
a) Viết các phương trình hoá học xảy ra.
b) Để điều chế 200 000 tấn nitric acid có nồng độ 60% cần dùng bao nhiêu tấn ammonia? Biết rằng hiệu suất của quá trình sản xuất nitric acid theo sơ đồ trên là 96,2%.
Viết phương trình hoá học minh hoạ tác động của mưa acid đối với calcium carbonate trong núi đá vôi và với kim loại sắt có trong thép.
Trong mưa acid chứa sulfuric acid (H2SO4) và nitric acid (HNO3).
Công thức Lewis của HNO3 như dưới đây có phù hợp không?
Viết sơ đồ phản ứng gây ra mưa chứa nitric acid và sulfuric acid.
Hãy tìm hiểu, chỉ ra các hoạt động tạo thành các khí gây mưa acid tại địa phương em. Đề xuất một số biện pháp giảm thiểu sự tạo thành các khí đó.
Sơ đồ phản ứng sau đây cho thấy rõ vai trò của thiên nhiên và con người trong việc vận chuyển nitrogen từ khí quyển vào trong đất, cung cấp nguồn phân đạm cho cây cối:
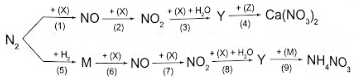
Hãy viết phương trình hoá học của các phản ứng trong sơ đồ chuyển hoá trên.
Tính nồng độ mol/L của dung dịch HNO3 60%, biết khối lượng riêng của dung dịch là 1,41 g/mL.
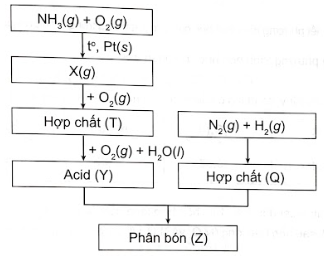
Sơ đồ quy trình dưới đây mô tả các bước trong quá trình sản xuất phân bón (Z). Hãy xác định các chất (X), (T), (Y), (Q), (Z). Viết các phản ứng hoá học xảy ra.
Giải thích vì sao người ta dùng chai có màu tối để chứa và bảo quản dung dich nitric acid.
Cho phản ứng: aFe + bHNO3 → cFe(NO3)3 + dNO↑ + eH2O
Hệ số tỉ lượng a, b, c, d, e là những số nguyên dương có tỉ lệ tối giản. Tổng (a + b) bằng
A. 3. B. 5. C. 4. D. 6.
Cho phản ứng: Fe3O4 + HNO3→ Fe(NO3)3 + NO↑ + H2O
Hệ số tỉ lượng của HNO3 trong phương trình hoá học trên là
A. 4. B. 1. C. 28. D. 10.
Hiện tượng mưa acid
A. là hiện tượng sẵn có trong tự nhiên.
B. xảy ra do sự bốc hơi của nước rồi ngưng tụ.
C. xảy ra khi nước mưa có pH < 7.
D. xảy ra khi nước mưa có pH < 5,6.
Vàng tan trong hỗn hợp gồm dung dịch nitric acid đặc và dung dịch hydrochloric acid đặc (tỉ lệ 1:3 về thể tích) tạo ra hợp chất tan của Au3+ theo phản ứng sau:
\(Au + HN{O_3} + HCl \to HAuC{l_4} + {H_2}O + NO\)
a) Cân bằng phương trình hóa học của phản ứng trên theo phương pháp thăng bằng electron.
b) Cho biết acid nào đóng vai trò chất oxi hóa trong phản ứng trên. Giải thích
8 a) Viết cấu hình electron của nguyên tử nitrogen (\(_7N\)) theo ô orbital. Nguyên tử N có bao nhiêu electron hóa trị ghép đôi, bao nhiêu electron độc thân?
b) Có hai đề xuất về công thức Lewis của phân tử HNO3 như bên:
b1) Công thức (A) hay (B) phù hợp với đặc điểm của electron hóa trị của nguyên tử nitrogen? Theo công thức đó, hóa trị và số oxi hóa của N là bao nhiêu?
b2) Kết quá nghiên cứu cho biết giá trị độ dài của liên kết giữa nguyên tử N và O (liên kết NO) trong phân tử HNO3 là 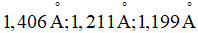 Công thức (A) hay (B) có thể thỏa mãn các số liệu đã cho? Giải thích.
Công thức (A) hay (B) có thể thỏa mãn các số liệu đã cho? Giải thích.
Sử dụng các hoá chất, dụng cụ: dung dịch nitric acid 20%, cân, tủ hút khí độc, cốc, đũa thuỷ tinh, phễu lọc, giấy lọc. Trình bày các bước xác định gần đúng hàm lượng vàng (gold) có trong hợp kim Au-Ag, trong đó hàm lượng vàng < 30% về khối lượng. Viết các phương trình hoá học xảy ra.
a) Viết phương trình hoá học xảy ra khi cho dung dịch HNO3 loãng lần lượt tác dụng với các chất: NaHCO3, Cu.
b) Trình bày phương pháp hoá học phân biệt ba dung dịch: HNO3, NaNO3, HCl.
Cho dung dịch HNO3 tác dụng với các chất sau: NH3, CaCO3, Ag, NaOH. Số phản ứng trong đó HNO3 đóng vai trò acid Brønsted là?
A. 4. B. 1. C. 3. D. 2.
Trong công nghiệp, quá trình sản xuất Ca(NO3)2 dùng làm phân bón được thực hiện bằng phản ứng giữa dung dịch HNO3 với hợp chất phổ biến, giá rẻ nào sau đây?
A. Cao. B. Ca(OH)2. C. CaCO3. D. CaSO4.
Để điều chế được silver nitrate từ một mẫu silver (bạc) tinh khiết, cần hoà tan mẫu silver vào dung dịch nào sau đây?
A. Cu(NO3)2. B. HNO3. C. NaNO3. D. KNO3.
Nitric acid dễ bị phân huỷ bởi ánh sáng hoặc nhiệt độ, tạo thành các sản phẩm là
A. NO2, H2O. B. NO2, O2, H2O. C. N2, O2, H2O. D. N2, H2O.







Danh sách bình luận