Đun nóng 9,6 gam bột Mg với 9,6 gam bột lưu huỳnh (trong điều kiện không có không khí), thu được chất rắn X. Cho toàn bộ X vào lượng dư dung dịch HCl, thu được V lít khí (đkc). Giá trị của V là bao nhiêu ?
Dựa vào tính chất hóa học của lưu huỳnh.
nMg = 0,4 mol; nS = 0,3 mol
Mg + S \( \to \) MgS.
0,4 0,3
0,3 \( \leftarrow \)0,3 \( \to \) 0,3 mol
\( \to \)Rắn X ( 0,3 mol MgS và 0,1 mol Mg) + HCl \( \to \) 0,3 mol H2O và 0,1 mol H2.
\( \to \)V = 0,4.24,79 = 9,916 lít.

Các bài tập cùng chuyên đề
1. Viết cấu hình electron của nguyên tử S (Z = 16) và biểu diễn sự phân bố electron vào các ô orbital.
2. Dựa vào cấu hình elecron và độ âm điện của nguyên tử S, hãy đưa ra dự đoán về:
a) Số oxi hoá thấp nhất, cao nhất của nguyên tử S trong hợp chất.
b) Tính oxi hoá, tính khử của sulfur.
Thí nghiệm: Sulfur tác dụng với sắt (iron)
Chuẩn bị: bột sulfur, bột iron, ống nghiệm, kẹp gỗ, đèn cồn, bông.
Tiến hành:
- Trộn đều bột sulfur với bột iron theo tỉ lệ khối lượng khoảng 1 : 1,5.
- Lấy khoảng 2 g hỗn hợp vào ống nghiệm khô chịu nhiệt, dùng bông nút miệng ống nghiệm.
- Hơ nóng đều nửa dưới ống nghiệm trên ngọn lửa đèn cồn, sau đó đun tập trung vào phần chứa hỗn hợp.
Quan sát, mô tả hiện tượng và thực hiện yêu cầu sau:
Dự đoán sản phẩm tạo thành sau thí nghiệm, viết phương trình hoá học của phản ứng và xác định chất oxi hoá, chất khử.
Thí nghiệm: Sulfur tác dụng với oxygen
Chuẩn bị: bột sulfur, bình khí oxygen, muôi sắt, đèn cồn, nút cao su.
Tiến hành:
- Lấy một ít bột sulfur vào muôi sắt (đã cắm xuyên qua nút cao su).
- Hơ nóng muôi sắt trên ngọn lửa đèn cồn đến khi sulfur nóng chảy và chảy một phần trong không khí.
- Đưa nhanh muôi sắt vào bình khí oxygen.
Quan sát và thực hiện các yêu cầu:
1. Viết phương trình hoá học và xác định chất oxi hoá, chất khử.
2. Nhận xét mức độ phản ứng cháy của sulfur trong không khí và trong khí oxygen
Phản ứng của sulfur với hydrogen, nhôm (aluminium), thủy ngân (mercury) và fluorine, hãy xác định sự thay đổi số oxi hóa của nguyên tử các nguyên tố. Sulfur là chất oxi hóa hay chất khử?
Nêu hiện tượng xảy ra ở Thí nghiệm 1. Xác định vai trò của các chất trong phản ứng của Fe và S ở thí nghiệm này.
Nêu hiện tượng xảy ra ở Thí nghiệm 2. Xác định vai trò của các chất trong phản ứng của S và O2, ở thí nghiệm này.
Viết phương trình hoá học của phản ứng xảy ra khi cho nhôm (aluminium) và kẽm (zinc) tác dụng với sulfur.
Thuỷ ngân rất độc. Hít phải hơi thuỷ ngân có thể gây hại cho hệ thần kinh, hệ tiêu hoá và hệ miễn dịch, gây nhiễm độc phổi và thận, nguy cơ dẫn đến tử vong. Hãy nêu cách xử lí thuỷ ngân khi nhiệt kế thuỷ ngân không may bị vỡ.
Hãy nêu một số ứng dụng của sulfur đơn chất trong đời sống và sản xuất.

Thí nghiệm 1. Tính oxi hoá của sulfur
Chuẩn bị: Bột sulfur, bột sắt, giấy lọc, ống nghiệm chịu nhiệt, đũa thuỷ tinh, đèn cồn, giá thí nghiệm.
Tiến hành: Trộn đều hỗn hợp gồm khoảng 1 gam bột sắt và 0,6 gam bột sulfur trên mảnh giấy lọc. Cho hỗn hợp vào ống nghiệm chịu nhiệt, đặt ống nghiệm lên giá thí nghiệm. Đun nóng ống nghiệm trên ngọn lửa đèn cồn cho đến khi hỗn hợp “chảy” và hoá đen.
Yêu cầu: Viết phương trình hoá học của phản ứng đã diễn ra và cho biết vai trò của các chất trong phản ứng.
Thí nghiệm 2. Tính khử của sulfur
Chuẩn bị: Bột sulfur, giấy quỳ tím, muỗng đốt hoá chất (đã xuyên qua nút cao su), bình tam giác (loại nhỏ) chứa nước và khí oxygen.
Tiến hành: Dùng muỗng đốt hóa chất (đã được xuyên qua nút cao su) lấy một ít bột sulfur (khoảng 1/2 muỗng). Đeo khẩu trang. Đốt muỗng chứa sulfur trên ngọn lửa đèn cồn. Khi sulfur cháy thì đưa nhanh muỗng đốt vào bình tam giác chứa sẵn khí oxygen và một ít nước. Đậy kín bình bằng cách di chuyển nhanh nút cao su trên muỗng vào miệng bình. Khi ngọn lửa trong bình đã tắt thì lắc nhẹ bình rồi để yên khoảng 1 phút. Dùng giấy quỳ tím thử pH của dung dịch trong bình tam giác.
Yêu cầu: Viết phương trình hoá học của các phản ứng xảy ra trong quá trình thí nghiệm. Giải thích các hiện tượng quan sát được.
Nối những đặc điểm của chất ở cột B với tên chất ở cột A cho phù hợp.
|
Cột A |
Cột B |
|
a) Sulfur
|
1. Là chất khí ở điều kiện thường. |
|
2. Ở điều kiện thường, phân tử có 8 nguyên tử. |
|
|
3. Dễ tan trong nước. |
|
|
b) Sulfur dioxide
|
4. Hoà tan trong dung môi phù hợp để làm thuốc trị bệnh ngoài da. |
|
5. Dùng để tẩy trắng vải, sợi. |
|
|
6. Có tính khử và tính oxi hoá. |
Thuỷ ngân là kim loại nặng rất độc. Việc con người tiếp xúc với thuỷ ngân trong thời gian dài dẫn đến run rẩy, mất khả năng điều hoà vận động, thay đổi tính cách, mất trí nhớ, mất ngủ, mệt mỏi, đau đầu, giảm cân, căng thẳng tâm lí và viêm lợi. Các triệu chứng này xảy ra khi một người tiếp xúc với nồng độ thuỷ ngân trong không khí trên 50 µg/m3 . Thuỷ ngân độc hơn khi ở thể hơi vì dễ dàng hấp thụ vào cơ thể qua nhiều con đường như đường hô hấp, đường tiêu hoá, qua da, ... Trong trường hợp thuỷ ngân rơi vãi, cần xử lí như thế nào? Liên hệ với tình huống xử lí an toàn khi vô tình làm vỡ nhiệt kế thuỷ ngân trong phòng thí nghiệm.
Cho các phản ứng hoá học sau:
\[\begin{array}{l}{\rm{(1) S + }}{{\rm{O}}_{\rm{2}}} \to {\rm{SO}}{}_{\rm{2}}\\({\rm{2) S + 3}}{{\rm{F}}_{\rm{2}}} \to {\rm{S}}{{\rm{F}}_{\rm{6}}}\\{\rm{(3) S + Hg}} \to {\rm{HgS}}\\{\rm{(4) S + 6HN}}{{\rm{O}}_{\rm{3}}}_{{\rm{(dac)}}} \to {{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}{\rm{ + 6N}}{{\rm{O}}_{\rm{2}}}{\rm{ + 2}}{{\rm{H}}_{\rm{2}}}{\rm{O}}\end{array}\]
Trong các phản ứng trên, số phản ứng trong đó S thể hiện tính khử là
A. 3. B. 2. C. 4. D. 1.
Phản ứng chuyển hóa hydrogen sulfide trong khí thiên nhiên thành sulfur được thực hiện theo sơ đồ phản ứng:
H2S + SO2 → S + H2O
Khối lượng sulfur tối đa tạo ra khi chuyển hoá 1 000 m3 khí thiên nhiên (đkc) (chứa 5 mg H2S/m3) là
A. 10,0 g. B. 5,0 g. C. 7,06 g. D.100,0 g.
Sulfur và quặng pyrite sắt là các nguyên liệu chính trong công nghiệp sản xuất sulfuric acid.
Tại một nhà máy, cứ đốt cháy 1 tấn quặng pyrite sắt (chứa 84% khối lượng FeS2) bằng không khí, thu được tối đa V m3 khí SO2 (đkc). Giá trị của V là
A. 173,5. B. 347,0. C. 86,8. D. 477,2.
Trong công nghiệp, phần lớn sulfur đơn chất sau khi khai thác ở các mỏ được dùng làm nguyên liệu để
A. lưu hoá cao su tự nhiên. B. sản xuất sulfuric acid.
C. điều chế thuốc bảo vệ thực vật. D. bảo chế thuốc đông y.
Trong phản ứng: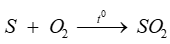 . Sulfur đóng vai trò là
. Sulfur đóng vai trò là
-
A.
chất khử.
-
B.
chất oxi hóa.
-
C.
chất bị khử.
-
D.
kim loại.
Học sinh A tiến hành thí nghiệm đốt cháy sulfur với bột sắt như sau:
Bước 1: lấy thìa nhỏ bột sắt và thìa nhỏ bột sulfur, trộn đều và cho vào ống nghiệm. Nút ống nghiệm bằng bông.
Bước 2: Đun nóng ống nghiệm có chứa hỗn hợp trên ngọn lửa đèn cồn đến khi có đốm sáng xuất hiện trong ống nghiệm thì ngừng đun, tắt đèn cồn.
Sau bước 1, phản ứng đã xảy ra nhưng chậm.
Sau bước 2, thấy hỗn hợp cháy sáng, kết thúc phản ứng hỗn hợp chuyển thành chất bột màu đen.
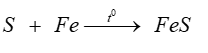
Sản phẩm tạo thành sau bước 2 là muối iron (III) sulfide.
Phương trình phản ứng xảy ra ở bước 2 là:
Cho sulfur lần lượt phản ứng với các chất sau ở điều kiện thích hợp: iron, hydrogen, fluorine, mercury, potassium chlorate. Số phản ứng mà sulfur là chất oxi hóa?
Tính chất nào của sulfur dioxide được sử dụng để tẩy trắng bột giấy, khử màu trong sản xuất đường, chống nấm mốc cho sản phẩm mây tre, đan,…?
-
A.
SO2 là một chất khí
-
B.
SO2 vừa có tính khử và tính oxi hóa
-
C.
SO2 có khả năng tẩy trắng và diệt khuẩn
-
D.
SO2 là một oxide acid.
Cho các phát biểu sau:
(a) Sulfur là chất rắn, màu trắng, không tan trong nước.
(b) Sulfur và sulfur dioxide vừa có tính oxi hóa, vừa có tính khử.
(c) Khi phản ứng với hydrogen, sulfur thể hiện tính oxi hóa
(d) Nước thải sinh hoạt là một trong các nguồn phát thải khí SO2.
(e) Sulfur dioxide được sử dụng để tẩy trắng vải sợi, bột giấy, sản xuất sulfuric acid và diệt nấm mốc.
Số phát biểu đúng là
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Cho các phản ứng:
(1) SO2 + Cl2 + H2O → H2SO4 + HCl
(3) SO2 + H2S → S + H2O
(2) SO2 + Mg → S + MgO
(4) SO2 + O2 → SO3
(5) SO2 + NaOH → NaHSO3
(6) SO2 + NaOH → Na2SO3 + H2O
(7) SO2 + KMnO4 + H2O → H2SO4 + K2SO4 + MnSO4
Những phản ứng mà SO2 thể hiện tính khử là
-
A.
(1); (2); (4); (5).
-
B.
(2); (3); (6); (7).
-
C.
(1); (4); (7).
-
D.
(1); (7).
Khi cháy, sulfur cũng như hợp chất của sulfur tạo khí SO2. Khí SO2 làm mất tím dung dịch thuốc tím theo sơ đồ phản ứng: SO2 + KMnO4 + H2O ⟶ H2SO4 + MnSO4 + K2SO4. Hàm lượng sulfur cho phép trong xăng là dưới 0,30%. Để kiểm tra hàm lượng lưu hùynh trong một loại xăng, người ta đốt cháy hoàn toàn 10,0 gam xăng này, tạo sản phẩm cháy coi như chỉ gồm CO2, SO2 và H2O. Thấy lượng sản phẩm cháy này làm mất màu vừa đủ dung dịch có hòa tan 3,5.10-4 mol KMnO4. Hàm lượng sulfur có trong mẫu xăng trên là
-
A.
0,27%
-
B.
0,72%.
-
C.
0,35%.
-
D.
0,28%.
Phản ứng chuyển hóa hydrogen sulfide trong khí thiên nhiên thành sulfur được thực hiện Theo sơ đồ phản ứng: H2S + SO2 → S + H2O
Khối lượng sulfur tối đa tạo ra khi chuyển hóa 1000m3 khí thiên nhiên (đkc) (chứa 5mgH2S/m3) là
-
A.
10,0g.
-
B.
5,0g.
-
C.
7,06g.
-
D.
100,0g.
Khí SO2 (sinh ra từ việc đốt các nhiên liệu hóa thạch, quặng sulfide) là một trong những chất chủ yếu gây hiện tượng ô nhiễm môi trường nào sau đây?
-
A.
Mưa acid.
-
B.
Hiện tượng nhà kính.
-
C.
Lỗ thủng tầng ozone.
-
D.
Nước thải gây ung thư.
Khi nhiệt kế thuỷ ngân vỡ, rắc chất bột nào sau đây lên thuỷ ngân rơi vãi sẽ chuyển hoá chúng thành hợp chất bền, ít độc hại?
-
A.
Than đá.
-
B.
Đá vôi.
-
C.
Muối ăn.
-
D.
Sulfur.
Phản ứng chuyển hóa hydrogen sulfide trong khí thiên nhiên thành sulfur được thực hiện theo sơ đồ phản ứng: H2S + SO2 → S + H2O.
Khối lượng sulfur tối đa tạo ra khi chuyển hóa 1 000 m3 khí thiên nhiên (đkc) (chứa 5 mg H2S/m3) là
-
A.
10,0 g.
-
B.
5,0 g.
-
C.
7,06 g.
-
D.
100,0 g.







Danh sách bình luận