Ở cùng điều kiện áp suất, hydrogen fluoride (HF) có nhiệt độ sôi cao vượt trội so với các hydrogen halide còn lại là do
A. fluorine có nguyên tử khối nhỏ nhất.
B. năng lượng liên kết H – F bền vững làm cho HF khó bay hơi.
C. các nhóm phân tử HF được tạo thành do có liên kết hydrogen giữa các phân tử.
D. fluorine là phi kim mạnh nhất.
- Đáp án: C

Các bài tập cùng chuyên đề
Nêu xu hướng biến đổi độ dài liên kết trong dãy HX
Từ Bảng 22.2, hãy nhận xét xu hướng biến đổi nhiệt độ sôi của các hydrogen halide. Giải thích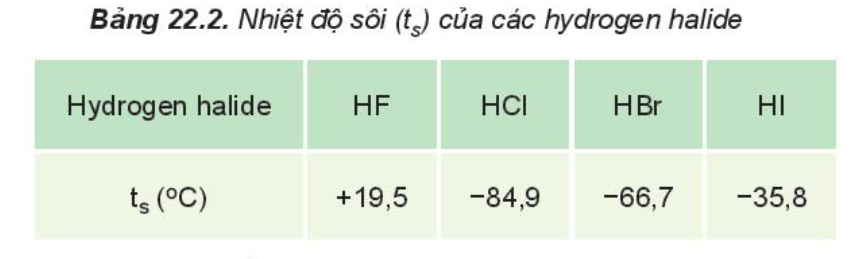
Ở một nhà máy sản xuất vàng từ quặng, sau khi cho dung dịch chứa hợp chất tan của vàng chảy qua cột chứa kẽm hạt, thu được chất rắn gồm vàng và kẽm. Đề xuất phương pháp thu được vàng tinh khiết
Dung dịch HCl tác dụng với kim loại
Chuẩn bị: 2 ống nghiệm, dung dịch HCl loãng, Zn dạng hạt, Cu dạng lá
Tiến hành:
- Cho vào 2 ống nghiệm, mỗi ống khoảng 2 mL dung dịch HCl loãng
- Cho vài hạt Zn vào ống (1), vài lá Cu vào ống (2)
Quan sát hiện tượng và viết phương trình hóa học
Dung dịch HCl tác dụng với muối NaHCO3 rắn
Chuẩn bị: dung dịch HCl loãng, muối NaHCO3 rắn, ống nghiệm
Tiến hành:
Cho thìa nhỏ NaHCO3 vào ống nghiệm, thêm tiếp dung dịch HCl loãng
Quan sát hiện tượng và trả lời câu hỏi:
1. Viết phương trình hóa học của phản ứng
2. So sánh tính acid của HCl và H2CO3
Viết phương trình hóa học khi cho dung dịch hydrochloric acid lần lượt tác dụng với: Fe, MgO, Cu(OH)2, AgNO3
Liên kết trong phân tử nào sau đây có độ phân cực lớn nhất?
A. H-F
B. H-Cl
C. H-Br
D. H-I
Giải thích tại sao xu hướng phân cực của các phân tử HX giảm dần từ HF đến HI
Dựa vào Bảng 18.1, hãy cho biết khí hydrogen halide nào sẽ hóa lỏng trước tiên khi nhiệt độ được hạ xuống thấp dần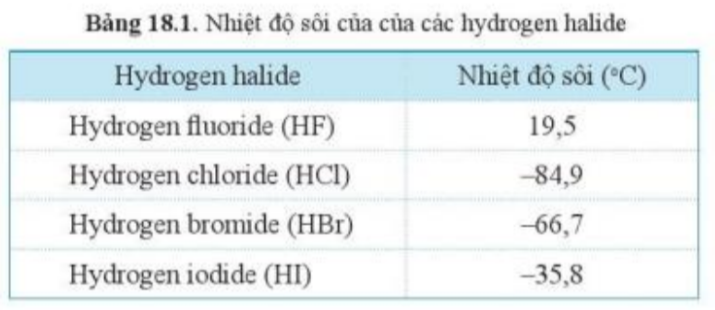
Hãy giải thích vì sao nhiệt độ sôi của hydrogen bromide cao hơn nhiệt độ sôi của hydrogen chloride
Quan sát hình bên, nếu bơm từ từ cho đến hết lượng nước trong xi – lanh vào bong bóng chứa khí hydrogen chloride thì hiện tượn gì sẽ xảy ra. Giải thích 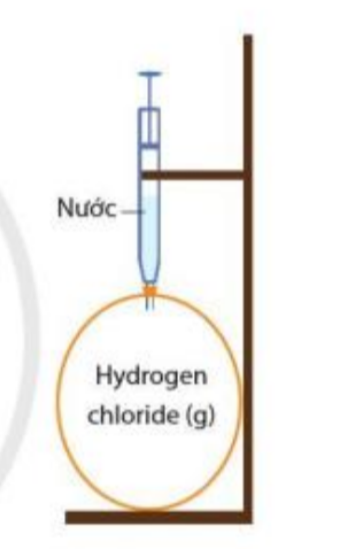
Trong phòng thí nghiệm, hydrochloric acid đặc có thể được dùng để điều chế khí chlorine theo hai phản ứng sau:
16HCl(aq) + 2KMnO4 (s) → 2MnCl2(aq) + 2KCl(aq) + 8H2O(l) + 5Cl2(g) (1)
4HCl(aq) + MnO2(s) → MnCl2(aq) + 2H2O(l) + Cl2 (g) (2)
Cho bảng giá trị enthalpy tạo thành chuẩn (kJ mol-1) của các chất như dưới đây:
|
HCl(aq) |
KMnO4(s) |
MnO2(s) |
MnCl2(aq) |
KCl(aq) |
H2O(l) |
|
-167 |
-837 |
-520 |
-555 |
-419 |
-285 |
a) Hãy tính biến thiên enthalpy chuẩn của mỗi phản ứng.
b) Thực tế, không cần đun nóng, hai phản ứng trên vẫn diễn ra ở nhiệt độ phòng. Vậy phản ứng trên đã có thể thu nhiệt từ đâu?
Xét phản ứng sau:
4HI(aq) + O2(g) → 2H2O(l) + 2I2(s)
Cho giá trị enthalpy tạo thành chuẩn (kJ mol-1) của một số chất trong bảng dưới đây:
|
HI (aq) |
H2O (l) |
O2 (g) |
I2 (s) |
|
-55 |
-285 |
? |
? |
a) Điền giá trị phù hợp vào ô còn trống.
b) Xác định biến thiên enthalpy chuẩn của phản ứng trên.
c) Nếu chỉ dựa vào giá trị biến thiên enthalpy chuẩn thì phản ứng trên có thuận lợi về mặt năng lượng không? Từ đó, hãy dự đoán hiện tượng xảy ra khi dung dịch hydroiodic acid tiếp xúc với không khí.
d) Thực tế, người ta phải chứa hydroiodic acid trong chai, lọ được đậy kín. Hãy giải thích.
Một trong những ứng dụng quan trọng của hydrochloric acid là dùng để loại bỏ gỉ thép trước khi đem cán, mạ điện, … Theo đó, thép sẽ được ngâm trong hydrochloric acid nồng độ khoảng 18% theo khối lượng. Các oxide tạo lớp gỉ trên bề mặt của thép, chủ yếu là các oxide của sắt và một phần sắt sẽ bị hòa tan bởi acid. Quá trình này thu được dung dịch (gọi là dung dịch A), chủ yếu chứa hydrochloric acid dư và iron(II) chloride được tạo ra từ phản ứng sắt khử ion Fe3+.
a) Viết phương trình hóa học của các phản ứng diễn ra. Các phản ứng này có phát thải khí độc vào môi trường không?
b) Để tái sử dụng acid, dung dịch A được đưa đến thiết bị phun, ở khoảng 180oC để thực hiện phản ứng:
4FeCl2 + 4H2O + O2 → 8HCl + 2Fe2O3
Sau quá trình trên, cần làm thế nào để thu được hydrochloric acid?
Điền vào chỗ trống tên gọi hoặc công thức phân tử của các chất tương ứng:
a) …….: HI b) …….: NaCl
c) Potassium iodide: …… d) …….: NaClO
Các phân tử HX đều phân cực, nhưng chỉ có các phân tử HF tạo được liên kết hydrogen với nhau. Giải thích.
Nối mỗi chất trong cột A với tính chất tương ứng của chúng trong cột B cho phù hợp.
|
Cột A |
Cột B |
|
a) Hydrogen fluoride |
1. Là chất khí ở điều kiện thường. |
|
b) Hydrofluoric acid |
2. Các phân tử tạo liên kết hydrogen với nhau. |
|
c) Hydrogen chloride |
3. Có nhiệt độ sôi cao nhất trong dãy hydrogen halide. |
|
d) Hydrochloric acid |
4. Là acid mạnh. |
|
5. Ăn mòn thuỷ tỉnh. |
|
|
6. Thường được dùng đề thuỷ phân các chất trong quá trình sản xuất. |
|
|
7. Hoà tan calcium carbonate có trong đá vôi, magnesium hydroxide, copper(II) oxide. |
Những phát biểu nào dưới đây là không đúng khi nói về các hydrohalic acid?
A. Đều là các acid mạnh.
B. Độ mạnh của acid tăng từ hydrofluoric acid đến hydroiodic acid, phù hợp xu hướng giảm độ bền liên kết từ HF đến HI.
C. Hoà tan được các oxide của kim loại, phản ứng được với các hydroxide kim loại.
D. Hoà tan được tất cả các kim loại.
E. Tạo môi trường có pH lớn hơn 7.
Những phát biểu nào dưới đây là đúng khi nói về các hydrogen halide HX?
A. Ở điều kiện thường, đều là chất khí.
B. Các phân tử đều phân cực.
C. Nhiệt độ sôi tăng từ hydrogen chloride đến hydrogen iodide, phù hợp với xu hướng tăng tương tác van der Waals từ hydrogen chloride đến hydrogen iodide.
D. Đều tan tốt trong nước, tạo các dung dịch hydrohalic acid tương ứng.
E. Năng lượng liên kết tăng dần từ HF đến HI.
Cho các dung dịch hydrochloric acid, sodium chloride, iodine, kí hiệu ngẫu nhiên là X, Y, Z.
Một số kết quả thí nghiệm được ghi lại ở bảng sau.
|
Chất thử |
Thuốc thử |
Hiện tượng |
|
X |
Hồ tinh bột |
Xuất hiện màu xanh tím |
|
Z |
Baking soda, NaHCO3 |
Có bọt khí bay ra |
Các dung dịch ban đầu được kí hiệu tương ứng là
A. Z, Y, X.
B. Y, X, Z.
C. Y, Z, X.
D. X, Z, Y.
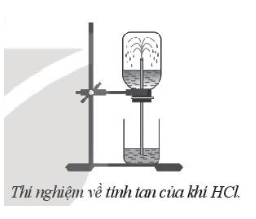
Thực hiện thí nghiệm thử tính tan của hydrogen chloride theo các bước sau:
- Bước 1 chuẩn bị một bình khô chứa khí HCl, đậy bình bằng nút cao su có ống thuỷ tinh xuyên qua và một cốc nước.
- Bước 2: nhúng ống thuỷ tinh vào cốc nước, thấy nước phun vào bình (xem hình bên).
a) Hiện tượng nước phun vào bình cho thấy áp suất khí HCl trong bình đã tăng hay giảm rất nhanh. Giải thích
b) Sự biến đổi áp suất như vậy đã chứng tỏ tính chất gì của khí HCl?
Phát biểu nào sau đây không đúng?
A. Dung dịch hydrofluoric acid có khả năng ăn mòn thuỷ tinh.
B. NaCl rắn tác dụng với H2SO4 đặc, nóng, thu được hydrogen chloride.
C. Hydrogen chloride tan nhiều trong nước.
D. Lực acid trong dãy hydrohalic acid giảm dần từ HF đến HI.
Trong dãy hydrohalic acid, từ HF đến HI, tính acid tăng dần do nguyên nhân chính là
A. tương tác van der Waals tăng dần.
B. độ phân cực liên kết giảm dần.
C. phân tử khối tăng dần.
D. độ bền liên kết giảm dần.
Dung dịch HF có khả năng ăn món thuỷ tinh là do xảy ra phản ứng hoá học nào sau đây?
A. SiO2 + 4HF → SiF4 + 2H2O.
B. NaOH + HF → NaF + H2O.
C. H2 + F2 → 2HF.
D. 2F2 + 2H2O → 4HF + O2.
Thuốc thử nào sau đây phân biệt được hai dung dịch HCl và NaCl?
A. Phenolphthalein.
B. Hồ tinh bột.
C. Quỳ tím.
D. Nước bromine.
Trong dãy hydrogen halide, từ HF đến HI, độ phân cực của liên kết biến đổi như thế nào?
A. Tuần hoàn.
B. Tăng dần.
C. Giảm dần.
D. Không đổi.
Trong dãy hydrogen halide, từ HCl đến HI, nhiệt độ sôi tăng dần chủ yếu do nguyên nhân nào sau đây?
A. Tương tác van der Waals tăng dần.
B. Phân tử khối tăng dần
C. Độ bền liên kết giảm dần.
D. Độ phân cực liên kết giảm dần.
Hydrohalic acid thường được dùng để đánh sạch bề mặt kim loại trước khi mạ điện là
A. HBr.
B. HF.
C. HI.
D. HCl.







Danh sách bình luận