Quặng pyrite có thành phần chính là FeS2 được dùng làm nguyên liệu để sản xuất sulfuric acid. Xét phản ứng đốt cháy:
a) Lập phương trình hoá học của phản ứng theo phương pháp thăng bằng electron.
b) Tính thể tích không khí (chứa 21% thể tích oxygen ở điều kiện chuẩn) cần dùng để đốt cháy hoàn toàn 2,4 tấn FeS2 trong quặng pyrite
Dựa vào
- Các bước cân bằng phản ứng oxi hóa - khử
+ Bước 1: Xác định số oxi hóa của các nguyên tử có sự thay đổi số oxi hóa trong phản ứng
=>Xác định chất oxi hóa, chất khử
+ Bước 2: Viết quá trình oxi hóa và quá trình khử
+ Bước 3: Xác định (và nhân) hệ số thích hợp vào các quá trình sao cho tổng số electron chất khử nhường bằng tổng số electron chất oxi hóa nhận
+ Bước 4: Đặt các hệ số vào sơ đồ phản ứng. Cân bằng số lượng nguyên tử của các nguyên tố còn lại

Các bài tập cùng chuyên đề
Trong lò luyện gang, xảy ra phản ứng oxi hóa – khử theo sơ đồ:
Fe2O3 + CO \(\xrightarrow{{{t^o}C}}\) Fe + CO2
Về bản chất, phản ứng oxi hóa - khử là gì, dựa vào dấu hiệu nào để nhận ra loại phản ứng đó?
Làm thế nào để lập phương trình hóa học của phản ứng trên?
Trong không khí ẩm, Fe(OH)2 màu trắng xanh chuyển dần sang Fe(OH)3 màu nâu đỏ:
Fe(OH)2 + O2 + H2O → Fe(OH)3
a) Hãy xác định các nguyên tử có sự thay đổi số oxi hóa.
b) Viết quá trình oxi hóa, quá trình khử.
c) Dùng mũi tên biểu diễn sự chuyển electron từ chất khử sang chất oxi hóa
Xét các phản ứng hóa học xảy ra trong công nghiệp:
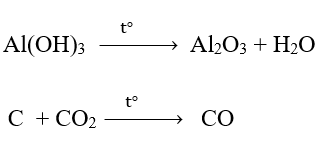
Phản ứng nào là phản ứng oxi hóa – khử? Lập phương trình hóa học của phản ứng oxi hóa khử theo phương pháp thăng bằng electron.
Nêu một số phản ứng oxi hóa – khử có lợi và có hại trong thực tế.
Lập phương trình hóa học của các phản ứng trong quá trình sản xuất sulfuric acid theo sơ đồ mục IV.3. Trong các phản ứng đó, phản ứng nào là phản ứng oxi hóa – khử?
Đèn xì ogygen – acetylene có cấu tạo gồm hai ống dẫn khí: một ống dẫn khí oxygen, một ống dẫn khí acetylene (Hình 15.1). Khi đèn hoạt động, hai khí này được trộn vào nhau để thực hiện phản ứng đốt cháy theo sơ đồ:
C2H2 + O2 \(\xrightarrow{{{t^o}}}\) CO2 + H2O
Phản ứng tỏa nhiệt lớn, tạo ra ngọn lửa có nhiệt độ đạt đến 30000C nên được dùng để hàn cắt kim loại.
Hãy xác định chất oxi hóa, chất khử và lập phương trình hóa học của phản ứng trên theo phương pháp thăng bằng electron.
Trong quá trình luyện gang từ quặng chứa Fe2O3, ban đầu không khí nóng được nén vào lò cao, đốt cháy hoàn toàn than cốc kèm theo tỏa nhiệt mạnh:
C + O2 \(\xrightarrow{{{t^o}}}\) CO2
Khí CO2 đi lên phía trên, gặp các lớp than cốc và bị khử thành CO:
CO2 + C \(\xrightarrow{{{t^o}}}\) CO
Tiếp đó, khí CO khử Fe2O3 theo phản ứng tổng quát:
Fe2O3 + CO \(\xrightarrow{{{t^o}}}\) Fe + CO2
Lập các phương trình hóa học ở trên, chỉ rõ chất oxi hóa, chất khử
Copper (II) sulfate được dùng để diệt tảo, rong rêu trong nước bể bơi; dùng để pha chế thuốc Bordaux ( trừ bệnh mốc sương trên cây cà chua, khoai tây; bệnh thối thân trên cây ăn quả, cây công nghiệp)…
Cu + O2 + H2SO4 → CuSO4 + H2O (1)
a) Lập phương trình hóa học của phản ứng (1) theo phương pháp thăng bằng electron, chỉ rõ chất oxi hóa, chất khử.
b) Copper (II) sulfate còn được điều chế bằng cách cho đồng phế liệu tác dụng với sulfuric acid đặc, nóng:
Cu + H2SO4 (đặc) \(\xrightarrow{{{t^o}}}\) CuSO4 + SO2 + H2O (2)
Trong hai cách trên, cách nào sử dụng ít sulfuric acid hơn, cách nào ít gây ô nhiễm môi trường hơn?
Xét phản ứng trong giai đoạn đầu của quá trình Ostwald:
NH3 + O2 → NO + H2O
Trong công nghiệp, cần trộn 1 thể tích khí ammonia với bao nhiêu thể tích không khí để thực hiện phản ứng trên? Biết không khí chứa 21% thể tích oxygen và các thể tích khi đo ở cùng điều kiện về nhiệt độ và áp suất.
Xét các phản ứng hóa học xảy ra trong các quá trình sau:
a) Luyện gang từ quặng hematit đó:
Fe2O3 + CO \(\xrightarrow{{{t^o}}}\) FeO + CO2
FeO + CO \(\xrightarrow{{{t^o}}}\) Fe + CO2
b) Luyện kẽm từ quặng blend:
ZnS + O2 \(\xrightarrow{{{t^o}}}\) ZnO + SO2
ZnO + C \(\xrightarrow{{{t^o}}}\) Zn + CO
c) Sản xuất xút, chlorine từ dung dịch muối ăn:
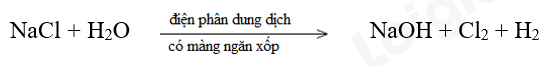
d) Đốt cháy ethanol có trong xăng E5:
C2H5OH + O2 \(\xrightarrow{{{t^o}}}\) CO2 + H2O
Hãy chỉ ra các phản ứng oxi hóa – khử, lập phương trình hóa học của các phản ứng đó theo phương pháp thăng bằng electron và chỉ rõ chất oxi hóa, chất khử.
Cho nước Cl2 vào dung dịch NaBr xảy ra phản ứng hóa học:
Cl2 + 2NaBr → 2NaCl + Br2
Trong phản ứng hóa học trên, xảy ra quá trình oxi hóa chất nào?
A. NaCl.
B. Br2.
C. Cl2.
D. NaBr.
Trong phản ứng hóa học: 2Na + 2H2O → 2NaOH + H2, chất oxi hóa là
A. H2O
B. NaOH
C. Na
D. H2
Trong phản ứng hóa học: Fe + H2SO4 → FeSO4 + H2, mỗi nguyên tử Fe đã
A. nhường 2 electron
B. nhận 2 electron
C. nhường 1 electron
D. nhận 1 electron
Trong phản ứng oxi hóa – khử, chất oxi hóa là chất
A. nhận electron
B. nhường proton
C. nhường electron
D. nhận proton
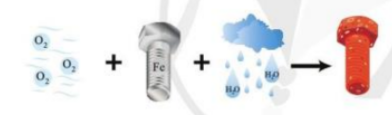
Quá trình bị gỉ của đinh ốc ngoài không khí được mô tả như hình dưới đây:
Trong quá trình này, hãy cho biết nguyên tử nguyên tố nào nhường electron, nguyên tố nào nhận electron. Giải thích.
Trong phản ứng ở ví dụ 1, hãy chỉ ra chất khử, chất oxi hóa, quá trình khử, quá trình oxi hóa.
Cân bằng các phản ứng oxi hóa – khử sau. Chỉ ra chất oxi hóa, chất khử, sự oxi hóa, sự khử.
Fe2O3 + CO → Fe + CO2
NH3 + O2 → NO + H2O
Các phản ứng trên thường gặp trong cuộc sống và sản xuất. Những phản ứng này thường diễn ra trong quá trình nào?
Cân bằng các phản ứng oxi hóa – khử sau:
a) HCl + PbO2 → PbCl2 + Cl2 + H2O
b) KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
Hãy viết các quá trình thay đổi số oxi hóa của mỗi nguyên tử nguyên tố trong phản ứng oxi hóa hoàn toàn methane.
Xác định chất oxi hóa, chất khử, quá trình oxi hóa, quá trình khử trong các phản ứng sau:
a) Ag+ + Fe2+ → Ag + Fe3+
b) 3Hg2+ + 2Fe → 3Hg + 2Fe3+
c) 2As + 3Cl2 → 2AsCl3
d) Al + 6H+ + 3NO3- → Al3+ + 3NO2 + 3H2O
Cân bằng các phản ứng oxi hóa – khử sau đây bằng Phương pháp giải thăng bằng electron
a) NaBr + Cl2 → NaCl + Br2
b) Fe2O3 + CO → Fe + CO2
c) CO + I2O5 → CO2 + I2
d) Cr(OH)3 + Br2 + OH- → CrO42- + Br- + H2O
e) H+ + MnO4- + HCOOH → Mn2+ + H2O + CO2
Nước oxy già có tính oxi hóa mạnh, do khả năng oxi hóa của hydrogen peroxide (H2O2).
a) Từ công thức cấu tạo H – O – O – H, hãy xác định số oxi hóa của mỗi nguyên tử.
b) Nguyên tử nguyên tố nào gây nên tính oxi hóa của H2O2. Viết các quá trình oxi hóa, quá trình khử minh họa.
Xăng E5 là một loại xăng sinh học, được tạo thành khi trộn 5 thể tích ethanol C2H5OH (cồn) với 95 thể tích xăng truyền thống, giúp thay thế một phần nhiên liệu hóa thạch, phù hợp với xu thế phát triển chung trên thế giới và góp phần đảm bảo an ninh năng lượng quốc gia.
Viết phương trình đốt cháy ethanol thành CO2 và H2O. Phản ứng này có phải là phản ứng oxi hóa – khử hay không? Nó thuộc loại phản ứng cung cấp hay tích trữ năng lượng?
Đom đóm có thể phát ra ánh sáng đặc biệt, không tỏa nhiệt như ánh sáng nhân tạo. Cấu tạo bên trong lớp da bụng của đom đóm là dãy các tế bào phát quang có chứa luciferin. Luciferin tác dụng với oxygen, cùng xúc tác enzyme, để tạo ra ánh sáng. Đây là phản ứng oxi hóa – khử.
Trong cuộc sống cũng như trong tự nhiên có nhiều hiện tượng mà nguyên nhân chính là do phản ứng oxi hóa – khử gây ra. Phản ứng oxi hóa – khử là gì? Vai trò quan trọng của chúng trong cuộc sống như thế nào? 
Cho phương trình hóa học của các phản ứng sau:
H2S + Br2 → 2HBr + S↓ (1)
2KClO3 2KCl + 3O2↑ (2)
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O (3)
Phản ứng nào là phản ứng oxi hóa – khử? Vì sao? Hãy xác định quá trình oxi hóa và quá trình khử của các phản ứng đó
Làm thế nào để biết một phản ứng là phản ứng oxi hóa – khử?
Lập phương trình hóa học của các phản ứng oxi hóa – khử sau, xác định vai trò của các chất tham gia phản ứng.
\(KMn{O_4} + HCl \to KCl + MnC{l_2} + C{l_2} \uparrow + {H_2}O(1)\)
\(N{H_3} + B{r_2} \to {N_2} + HBr(2)\)
\(N{H_3} + CuO\xrightarrow{{{t^o}}}Cu + {N_2} + {H_2}O(3)\)
\(Fe{S_2} + {O_2}\xrightarrow{{{t^o}}}F{e_2}{O_3} + S{O_2}(4)\)
\(KCl{O_3}\xrightarrow{{{t^o},Mn{O_2}}}KCl + {O_2} \uparrow \)(5)
Lập phương trình hóa học của phản ứng đốt cháy gas trong không khí và phản ứng kích nổ hỗn hợp nhiên liệu của tàu con thoi. Xác định vai trò của các chất trong mỗi phản ứng
Quan sát Hình 12.7 và độc thông tin, hãy lập phương trình hóa học của phản ứng quang hợp ở cây xanh. Quá trình quang hợp của thực vật có vai trò quan trọng như thế nào đối với cuộc sống?

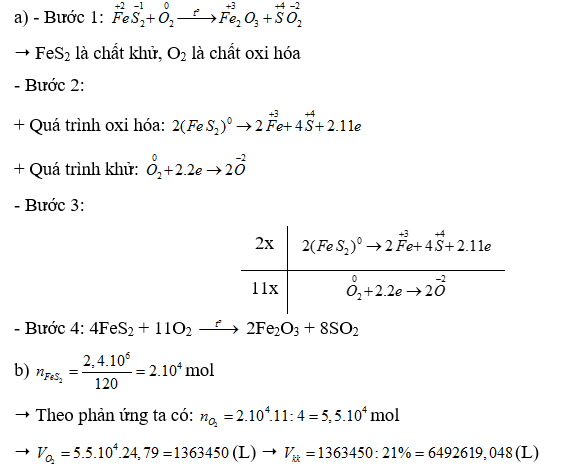






Danh sách bình luận